题目内容
【题目】铜是重要的过渡元素,其单质及化合物具有广泛用途。回答下列问题:
(1)铜元素基态原子的价电子排布式________________________________。
(2)铜能形成多种配合物,如Cu2+与乙二胺(H2N-CH2-CH2-NH2)可形成如图所示配离子。
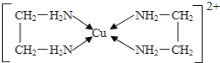
①Cu2+与乙二胺所形成的配离子中含有的化学键是_________________。
a.配位键 b.离子键 c.![]() 键 d.
键 d.![]() 键
键
②乙二胺分子中氮原子的杂化轨道类型为________________________,C、N、H三种元素的电负性由大到小顺序是________________________________。
③乙二胺和三甲胺[N(CH3)3]均属于胺,乙二胺的沸点比三甲胺高很多,原因是_______________。
(3)Cu2+在水溶液中以[Cu(H2O)4]2+形式存在,向含Cu2+的溶液中加入足量氨水,可生成更稳定的[Cu(NH3)4]2+,其原因是_____________________________。(请结合原子的性质进行回答)
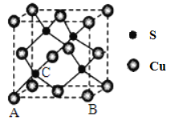
(4)Cu和S形成某种晶体的晶胞如图所示。
①该晶体的化学式为____________________
②该晶胞原子坐标参数A为(0,0,0);B为(1,0,0)。则C原子的坐标参数为____________________。
③已知该晶体的密度为d g·cm-3,Cu2+和S2-的半径分别为a pm和b pm,阿伏加德罗常数值为NA。列式表示该晶体中原子的空间利用率______________。
【答案】3d104s1 ac sp3 N>C>H 乙二胺分子间可形成氢键, 三甲胺分子间不能形成氢键 N 元素电负性更小, 更易给出孤对电子形成配位键 CuS (1/4,1/4,1/4) ![]()
【解析】
(1)铜是29号元素,基态铜原子的价电子排布式为3d104s1;
(2)①Cu2+与乙二胺形成的配离子为Cu(en)22+,配离子之间存在配位键,氮氢,碳氢之间存在极性键,碳碳之间存在非极性键,乙二胺分子中N均与H配位,共价键均为单键,即![]() 键,不存在
键,不存在![]() 键;
键;
②乙二胺分子中氮原子形成4个![]() 键,价层电子对数为4,氮原子为sp3杂化;C、N、H三种元素,吸引电子能力越强的元素其电负性越大,吸引电子能力大小顺序是N>C>H;
键,价层电子对数为4,氮原子为sp3杂化;C、N、H三种元素,吸引电子能力越强的元素其电负性越大,吸引电子能力大小顺序是N>C>H;
③乙二胺和三甲胺[N(CH3)3]均属于胺,乙二胺的沸点比三甲胺高很多,原因是乙二胺分子间可形成氢键, 三甲胺分子间不能形成氢键;
(3)N元素电负性更小,更易给出孤对电子形成配位键;
(4)①根据均摊法可得晶体中Cu原子个数为8![]() +6
+6![]() =4,S原子个数为4;
=4,S原子个数为4;
②根据各个原子的相对位置可知,D在各个方向的1/4处,所以其坐标是(1/4,1/4,1/4);③晶体中原子的空间利用率为晶胞中所含原子的体积占晶胞体积的百分比,以此计算。
(1)铜是29号元素,基态铜原子的价电子排布式为3d104s1;
故答案为:3d104s1;
(2)①Cu2+与乙二胺形成的配离子为Cu(en)22+,配离子之间存在配位键,氮氢,碳氢之间存在极性键,碳碳之间存在非极性键,乙二胺分子中N均与H配位,共价键均为单键,即![]() 键,不存在
键,不存在![]() 键,答案选ac;
键,答案选ac;
②乙二胺分子中氮原子形成4个![]() 键,价层电子对数为4,氮原子为sp3杂化;C、N、H三种元素,吸引电子能力越强的元素其电负性越大,吸引电子能力大小顺序是N>C>H,所以其电负性大小顺序是N>C>H;
键,价层电子对数为4,氮原子为sp3杂化;C、N、H三种元素,吸引电子能力越强的元素其电负性越大,吸引电子能力大小顺序是N>C>H,所以其电负性大小顺序是N>C>H;
③乙二胺和三甲胺[N(CH3)3]均属于胺,乙二胺的沸点比三甲胺高很多,原因是乙二胺分子间可形成氢键, 三甲胺分子间不能形成氢键;
故答案为:ac ;sp3 ;N>C>H;乙二胺分子间可形成氢键, 三甲胺分子间不能形成氢键;
(3)Cu2+在水溶液中以[Cu(H2O)4]2+形式存在,向含Cu2+的溶液中加入足量氨水,可生成更稳定的[Cu(NH3)4]2+,其原因是N元素电负性更小,更易给出孤对电子形成配位键;
故答案为:N元素电负性更小,更易给出孤对电子形成配位键;
(4)①根据均摊法可得晶体中Cu原子个数为8![]() +6
+6![]() =4,S原子个数为4,故晶体的化学式为CuS;
=4,S原子个数为4,故晶体的化学式为CuS;
故答案为:CuS;
②根据各个原子的相对位置可知,D在各个方向的1/4处,所以其坐标是(1/4,1/4,1/4);③已知该晶体的密度为d g·cm-3,Cu2+和S2-的半径分别为a pm和b pm,阿伏加德罗常数值为NA。一个晶胞中原子的体积为4![]() (a3+b3)
(a3+b3)![]() 10-30cm3,一个晶胞的体积为V=
10-30cm3,一个晶胞的体积为V=![]() =
=![]() ,故晶体中原子的空间利用率为
,故晶体中原子的空间利用率为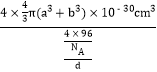 =
=![]() 。
。
故答案为:(1/4,1/4,1/4);![]() 。
。

 名校课堂系列答案
名校课堂系列答案