题目内容
14.SO2和CO2均可使澄清石灰水变浑浊,现将混合气体SO2和CO2依次通过①品红;②酸性高锰酸钾;③品红;④澄清石灰水;请写出对应序号的现象和作用;①品红;现象品红褪色;作用检验二氧化硫的存在;
②酸性高锰酸钾;现象溶液褪色;作用除去二氧化硫;
③品红;现象品红不褪色;作用证明二氧化硫已完全除尽;
④澄清石灰水;现象石灰水变浑浊;作用证明存在二氧化碳气体.
分析 将混合气体SO2和CO2依次通过①品红是检验二氧化硫气体的存在的;②二氧化硫具有还原性,用氧化剂酸性高锰酸钾,除去二氧化硫;③再通往品红,是验证二氧化硫是否除尽的;④通入澄清石灰水是检验二氧化碳气体存在的,由此分析解答.
解答 解:将混合气体SO2和CO2依次通过品红是检验二氧化硫气体的存在的;二氧化硫具有还原性,用氧化剂酸性高锰酸钾,除去二氧化硫;再通往品红,是验证二氧化硫是否除尽的;通入澄清石灰水是检验二氧化碳气体存在的;
①混合气体通入品红,现象是品红褪色,说明二氧化硫的存在,故答案为:品红褪色;检验二氧化硫的存在;
②通入酸性高锰酸钾,除去还原性的气体二氧化硫,观察到酸性高锰酸钾溶液褪色,作用是除去二氧化硫气体,故答案为:溶液褪色;除去二氧化硫;
③再通入品红,品红不褪色,说明二氧化硫已完全除尽,故答案为:品红不褪色;证明二氧化硫已完全除尽;
④通入澄清石灰水,石灰水变浑浊,说明存在二氧化碳气体,故答案为:石灰水变浑浊;证明存在二氧化碳气体.
点评 本题考查物质的检验与物质组成的测定、对实验装置的理解、元素化合物性质等知识,题目难度中等,掌握元素化合物的性质是解题的关键,注意掌握物质性质实验方案的设计原则,试题培养了学生的分析、理解能力及化学实验能力.

练习册系列答案
 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案
相关题目
19.短周期元素X、Y、W、R的原子序数依次增大,元素X是形成化合物种类最多的元素,Y、R同主族,R原子的最外层电子数是内层电子总数的一半,W单质是人类将太阳能转变为电能的常用材料.下列说法正确的是( )
| A. | W元素是硅元素 | |
| B. | 气态氢化物的稳定性:Y<R | |
| C. | X、W、Y的最高价氧化物的水化物酸性强弱顺序是X<Y<W | |
| D. | X、Y、W、R的原子半径由大到小的顺序为R>W>X>Y |
5. 甲烷、一氧化碳和氢气、甲醇等既是重要的燃料也是重要的化工原料.
甲烷、一氧化碳和氢气、甲醇等既是重要的燃料也是重要的化工原料.
已知:
①2H2(g)+O2(g)═2H2O(l)△H1=-571.6kJ•mol-1
②CH4(g)+$\frac{1}{2}$O2(g)═CO(g)+2H2(g)△H2=-36kJ•mol-1
③CH4(g)+H2O(g)═CO(g)+3H2(g)△H3=+216kJ•mol-1
(1)氢气的燃烧热为△H=-285.8kJ•mol-1,写出甲烷不完全燃烧生成一氧化碳和液态水的热化学方程式:CH4(g)+$\frac{3}{2}$O2(g)═CO(g)+2H2O(l)△H=-607.6kJ•mol-1.
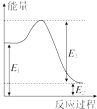
(2)现有1mol由H2O(g)与O2组成的混合气体,且O2的体积分数为x,将此混合气体与足量CH4充分反应.当x=0.75时,反应②与③放出(或吸收)的总能量为0.若②反应过程中能量转化过程如图所示,下列有关说法中正确的是C.
A.E1=36kJ B.E2=36kJ
C.E1-E2=36kJ D.E3-E1=36kJ
(3)工业上可通过CO和H2化合制得CH3OH:CO(g)+2H2(g)═CH3OH(g)△H1(CO结构式为C≡O).又知某些化学键的键能(断开1mol化学键时所需要的最低能量)数值如下表:
则△H1=-116kJ•mol-1,在相应的反应条件下,将1mol CO(g)与足量H2混合充分反应后,放出或吸收的热量<△H1.(用>,<或=填空)
 甲烷、一氧化碳和氢气、甲醇等既是重要的燃料也是重要的化工原料.
甲烷、一氧化碳和氢气、甲醇等既是重要的燃料也是重要的化工原料.已知:
①2H2(g)+O2(g)═2H2O(l)△H1=-571.6kJ•mol-1
②CH4(g)+$\frac{1}{2}$O2(g)═CO(g)+2H2(g)△H2=-36kJ•mol-1
③CH4(g)+H2O(g)═CO(g)+3H2(g)△H3=+216kJ•mol-1
(1)氢气的燃烧热为△H=-285.8kJ•mol-1,写出甲烷不完全燃烧生成一氧化碳和液态水的热化学方程式:CH4(g)+$\frac{3}{2}$O2(g)═CO(g)+2H2O(l)△H=-607.6kJ•mol-1.
(2)现有1mol由H2O(g)与O2组成的混合气体,且O2的体积分数为x,将此混合气体与足量CH4充分反应.当x=0.75时,反应②与③放出(或吸收)的总能量为0.若②反应过程中能量转化过程如图所示,下列有关说法中正确的是C.
A.E1=36kJ B.E2=36kJ
C.E1-E2=36kJ D.E3-E1=36kJ
(3)工业上可通过CO和H2化合制得CH3OH:CO(g)+2H2(g)═CH3OH(g)△H1(CO结构式为C≡O).又知某些化学键的键能(断开1mol化学键时所需要的最低能量)数值如下表:
| 化学键 | C-C | C-H | H-H | C-O | C≡O | H-O |
| 键能 (kJ•mol-1) | 348 | 413 | 436 | 358 | 1072 | 463 |
2.如图为元素周期表短周期的一部分,下列有关A、B、C、D四种元素的叙述正确的是( )

| A. | 原子半径大小为:B>A>C | B. | 核电荷数:D>C>B>A | ||
| C. | A与D形成的化合物均是离子键 | D. | 生成的氢化物的稳定性为:D>A>B |
9.下列分子中的所有原子都满足最外层8电子结构的是( )
| A. | 六氟化氙(XeF6) | B. | 次氯酸(HClO) | C. | 三氟化硼(BF3) | D. | 氮气 (N2) |
6.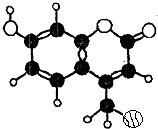 某种激光染料,应用于可调谐染料激光器,它由C、H、O三种元素组成.其一溴代物的分子球棍型如图所示,下列有关该溴代物的叙述正确的是( )
某种激光染料,应用于可调谐染料激光器,它由C、H、O三种元素组成.其一溴代物的分子球棍型如图所示,下列有关该溴代物的叙述正确的是( )
①该分子的核磁共振氢谱共有5种吸收峰
②能与溴水发生取代反应
③1mol该物质最多能与4molH2加成
④能使酸性KMnO4溶液褪色
⑤1mol该物质最多能与含3mol NaOH的溶液反应.
 某种激光染料,应用于可调谐染料激光器,它由C、H、O三种元素组成.其一溴代物的分子球棍型如图所示,下列有关该溴代物的叙述正确的是( )
某种激光染料,应用于可调谐染料激光器,它由C、H、O三种元素组成.其一溴代物的分子球棍型如图所示,下列有关该溴代物的叙述正确的是( )①该分子的核磁共振氢谱共有5种吸收峰
②能与溴水发生取代反应
③1mol该物质最多能与4molH2加成
④能使酸性KMnO4溶液褪色
⑤1mol该物质最多能与含3mol NaOH的溶液反应.
| A. | ①②③ | B. | ③④⑤ | C. | ②③④ | D. | ②③④⑤ |
3.已知断裂1mol C-H键,要吸收热量414.4kJ;断裂1mol C-C键,要吸收热量347.4kJ;生成1mol C═C键,会放出热量615.3kJ;生成1mol H-H键,会放出热量435.3kJ,某有机物分解的反应可表示为:

若在反应中消耗了1mol乙烷,则有关该反应的说法正确的是( )

若在反应中消耗了1mol乙烷,则有关该反应的说法正确的是( )
| A. | 该反应放出251.2 kJ的热量 | B. | 该反应吸收251.2 kJ的热量 | ||
| C. | 该反应放出125.6 kJ的热量 | D. | 该反应吸收125.6 kJ的热量 |
4.在含有NaI、Na2SO3和FeBr2各1mol的溶液中通入足量的Cl2,将溶液在空气中加热蒸干并充分灼烧,最终得到剩余的固体物质是( )
| A. | NaCl、FeCl3、Na2SO4、I2 | B. | NaCl、FeBr3、Na2SO4 | ||
| C. | NaCl、Fe2O3、Na2SO4 | D. | NaBr、FeCl3 |
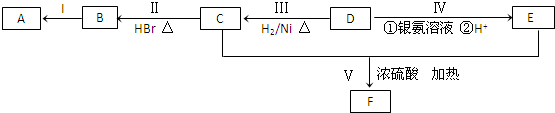
 .
. .
.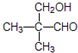 ;②
;② 、
、 .
.