题目内容
17.已知A、B、C、D、E均为短周期元素,它们的原子序数依次递增.A单质是自然界中密度最小的气体,C元素原子的最外层电子数是次外层的3倍,D原子的最内层电子数和最外层电子数之和等于其次外层电子数,E单质性质活泼;B和C可形成多种气态化合物.A、B、C三种元素可以形成离子化合物甲,甲是一种常见的化肥,甲可以和氢氧化钠反应放出无色刺激性气味气体乙,乙能使湿润的红色石蕊试纸变蓝.请回答下列问题:(1)写出C元素在周期表中的位置第二周期ⅥA族.
(2)写出B单质分子的电子式
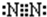 ;乙分子的结构式
;乙分子的结构式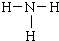 .
.(3)甲中含有的化学键类型有离子键、共价键.
(4)元素D与元素E相比,非金属性较强的是Cl(用元素符号表示),请列举能证明这一结论的两个事实氯化氢比硫化氢稳定、高氯酸酸性比硫酸强.
(5)往甲的浓溶液中加入NaOH的浓溶液并加热,反应的离子方程式是NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O.
分析 A、B、C、D、E均为短周期元素,它们的原子序数依次递增.A单质是自然界中密度最小的气体,则A为氢元素;C元素原子的最外层电子数是次外层的3倍,则C原子有2个电子层,最外层电子数为6,则C为氧元素;D原子的最内层电子数和最外层电子数之和等于其次外层电子数,则D原子最外层电子数为8-2=6,则D为硫元素;E单质性质活泼,原子序数大于硫元素,则E为Cl元素;B和C可形成多种气态化合物,A、B、C三种元素可以形成离子化合物甲,甲是一种常见的化肥,则B为氮元素,甲为硝酸铵;甲可以和氢氧化钠反应放出无色刺激性气味气体乙,乙能使湿润的红色石蕊试纸变蓝,则乙为氨气,以此解答.
解答 解:A、B、C、D、E均为短周期元素,它们的原子序数依次递增.A单质是自然界中密度最小的气体,则A为氢元素;C元素原子的最外层电子数是次外层的3倍,则C原子有2个电子层,最外层电子数为6,则C为氧元素;D原子的最内层电子数和最外层电子数之和等于其次外层电子数,则D原子最外层电子数为8-2=6,则D为硫元素;E单质性质活泼,原子序数大于硫元素,则E为Cl元素;B和C可形成多种气态化合物,A、B、C三种元素可以形成离子化合物甲,甲是一种常见的化肥,则B为氮元素,甲为硝酸铵;甲可以和氢氧化钠反应放出无色刺激性气味气体乙,乙能使湿润的红色石蕊试纸变蓝,则乙为氨气,
(1)C为氧元素,氧原子有2个电子层,最外层电子数为6,处于周期表中第二周期ⅥA族,
故答案为:第二周期ⅥA族;
(2)B为氮元素,氮气分子中氮原子之间形成3对共用电子对,氮气分子的电子式为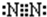 ,乙为氨气分子,分子中氮原子与氢原子之间形成1对共用电子对,氨气分子的结构式为
,乙为氨气分子,分子中氮原子与氢原子之间形成1对共用电子对,氨气分子的结构式为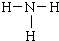 ,
,
故答案为: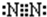 ;
;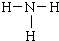 ;
;
(3)甲是硝酸铵,甲晶体中含有的化学键类型有:离子键、共价键,
故答案为:离子键、共价键;
(4)同周期自左而右非金属性增强,故非金属性Cl>S,氯化氢比硫化氢稳定、高氯酸酸性比硫酸强等证明这一结论,
故答案为:Cl;氯化氢比硫化氢稳定;高氯酸酸性比硫酸强;
(5)往硝酸铵的浓溶液中加入NaOH的浓溶液并加热,反应产生硝酸钠、氨气与水,反应的离子方程式是:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O,
故答案为:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O.
点评 本题考查结构性质位置关系、物质推断、常用化学用语等,难度不大,推断元素是解题的关键,注意对基础知识的理解掌握.

 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案| A. | 钚是f 区元素 | B. | 核外电子数238 | C. | 核内中子数 144 | D. | 钚是锕系元素 |
 甲烷、一氧化碳和氢气、甲醇等既是重要的燃料也是重要的化工原料.
甲烷、一氧化碳和氢气、甲醇等既是重要的燃料也是重要的化工原料.已知:
①2H2(g)+O2(g)═2H2O(l)△H1=-571.6kJ•mol-1
②CH4(g)+$\frac{1}{2}$O2(g)═CO(g)+2H2(g)△H2=-36kJ•mol-1
③CH4(g)+H2O(g)═CO(g)+3H2(g)△H3=+216kJ•mol-1
(1)氢气的燃烧热为△H=-285.8kJ•mol-1,写出甲烷不完全燃烧生成一氧化碳和液态水的热化学方程式:CH4(g)+$\frac{3}{2}$O2(g)═CO(g)+2H2O(l)△H=-607.6kJ•mol-1.
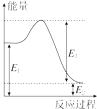
(2)现有1mol由H2O(g)与O2组成的混合气体,且O2的体积分数为x,将此混合气体与足量CH4充分反应.当x=0.75时,反应②与③放出(或吸收)的总能量为0.若②反应过程中能量转化过程如图所示,下列有关说法中正确的是C.
A.E1=36kJ B.E2=36kJ
C.E1-E2=36kJ D.E3-E1=36kJ
(3)工业上可通过CO和H2化合制得CH3OH:CO(g)+2H2(g)═CH3OH(g)△H1(CO结构式为C≡O).又知某些化学键的键能(断开1mol化学键时所需要的最低能量)数值如下表:
| 化学键 | C-C | C-H | H-H | C-O | C≡O | H-O |
| 键能 (kJ•mol-1) | 348 | 413 | 436 | 358 | 1072 | 463 |

| A. | 原子半径大小为:B>A>C | B. | 核电荷数:D>C>B>A | ||
| C. | A与D形成的化合物均是离子键 | D. | 生成的氢化物的稳定性为:D>A>B |
| A. | 六氟化氙(XeF6) | B. | 次氯酸(HClO) | C. | 三氟化硼(BF3) | D. | 氮气 (N2) |
 某种激光染料,应用于可调谐染料激光器,它由C、H、O三种元素组成.其一溴代物的分子球棍型如图所示,下列有关该溴代物的叙述正确的是( )
某种激光染料,应用于可调谐染料激光器,它由C、H、O三种元素组成.其一溴代物的分子球棍型如图所示,下列有关该溴代物的叙述正确的是( )①该分子的核磁共振氢谱共有5种吸收峰
②能与溴水发生取代反应
③1mol该物质最多能与4molH2加成
④能使酸性KMnO4溶液褪色
⑤1mol该物质最多能与含3mol NaOH的溶液反应.
| A. | ①②③ | B. | ③④⑤ | C. | ②③④ | D. | ②③④⑤ |
| a | 原子核外电子分别占3个不同能级,且每个能级上排布的电子数相同 |
| b | 基态原子的p轨道电子数比s轨道电子数少1 |
| c | 在周期表所列元素中电负性最大 |
| d | 位于周期表中第4纵行 |
| e | 基态原子M层全充满,N层只有一个电子 |
(1)d属于d区的元素,其基态原子的价电子排布图为
 .
.(2)b与其同周期相邻元素第一电离能由大到小的顺序为N>O>C(用元素符号表示).
(3)c的氢化物水溶液中存在的氢键有4种,任意画出一种
 、
、 、
、 、
、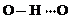 任意一种.
任意一种.(4)a与其相邻同主族元素的最高价氧化物的熔点高低顺序为SiO2>CO2(用化学式表示).若将a元素最高价氧化物水化物对应的正盐酸根离子表示为A,则A的空间构型为平面三角形;A的中心原子的轨道杂化类型为sp2杂化;与A互为等电子体的一种分子为SO3(填化学式).
(5)e与Au的合金可形成面心立方最密堆积的晶体,在晶胞中e原子处于面心,该晶体具有储氢功能,氢原子可进入到由e原子与Au原子构成的四面体空隙中,储氢后的晶胞结构与金刚石晶胞结构相似,该晶体储氢后的化学式为H4Cu3Au,若该晶体的相对分子质量为M,密度为ag/cm3,则晶胞的体积为$\frac{M}{a{N}_{A}}$cm3(NA用表示阿伏加德罗常数的值).

 ;
;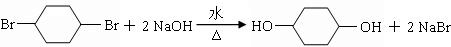 .
. .
. +O2$→_{△}^{催化剂}$
+O2$→_{△}^{催化剂}$ +2H2O.
+2H2O.