题目内容
7.X、Y、Z、W、R是5种短周期元素,其原子序数依次增大.X是周期表中原子半径最小的元素,Y原子最外层电子数是次外层电子数的3倍,Z、W、R处于同一周期,R与Y处于同一族,Z、W原子的核外电子数之和与Y、R原子的核外电子数之和相等.下列说法正确的是( )| A. | 元素Y、Z、W形成的离子具有相同电子层结构,其离子半径依次增大 | |
| B. | 39g Z2Y2中含有的离子数约为1.204×1024 | |
| C. | 元素Z、R的氧化物的水化物之间相互反应生成的盐溶液一定呈中性 | |
| D. | 元素Y、R分别与元素X形成的化合物的热稳定性:XmY>XmR |
分析 X、Y、Z、W、R 5种短周期元素,其原子序数依次增大,X是周期表中原子半径最小的元素,则A为H元素;Y原子最外层电子数是次外层电子数的3倍,Y原子有2个电子层,最外层电子数为6,故Y为O元素;R与Y处于同一族,则R为S元素;Z、W原子的核外电子数之和与Y、R原子的核外电子数之和相等,则Z、W原子的核外电子数之和为8+16=24,而Z、W、R处于同一周期,应为第三周期,原子序数W大于Z,故Z为Na,W为Al元素,据此解答.
解答 解:X、Y、Z、W、R 5种短周期元素,其原子序数依次增大,X是周期表中原子半径最小的元素,则A为H元素;Y原子最外层电子数是次外层电子数的3倍,Y原子有2个电子层,最外层电子数为6,故Y为O元素;R与Y处于同一族,则R为S元素;Z、W原子的核外电子数之和与Y、R原子的核外电子数之和相等,则Z、W原子的核外电子数之和为8+16=24,而Z、W、R处于同一周期,应为第三周期,原子序数W大于Z,故Z为Na,W为Al元素,
A.Y、Z、W元素形成的简单离子分别为O2-、Na+、Al3+,O2-、Na+、Al3+核外电子数都是10,具有相同电子层结构,半径随着核电荷数的增加而减小,所以离子半径O2->Na+>Al3+,故A错误;
B.每个Na2O2中含有3个离子,所以39g(即0.5mol) Na2O2中含有的离子数约为9.03×1023,故B错误;
C.Z的氧化物对应水化物为NaOH,R元素的氧化物的水化物为H2SO3、H2SO4,相互反应可以得到亚硫酸氢钠、硫酸氢钠、亚硫酸钠、硫酸钠,酸式盐溶液呈酸性,亚硫酸钠溶液呈碱性,硫酸钠溶液呈中性,故C错误;
D.由于氧的非金属性强于硫,所以元素S、O分别与元素H形成的化合物的热稳定性H2O>H2S,故D正确,
故选D.
点评 本题考查结构性质位置关系应用,推断元素是解题关键,难度中等,注意半径比较规律与元素周期律的灵活运用.


| A. | 该反应是取代反应 | |
| B. | 乙醛酸与H2在热的镍催化下反应生成乙二醇 | |
| C. | 1mol羟基扁桃酸能与3mol NaOH反应 | |
| D. | 1mol羟基扁桃酸能与1mol NaHCO3反应 |
| A. | 相对分子质量相同的物质是同种物质 | |
| B. | 分子式相同的不同有机物一定是同分异构体 | |
| C. | 具有同一通式的物质属于同系物 | |
| D. | 同分异构现象只存在于有机物中 |
| A. | 麦芽糖及其水解产物均能发生银镜反应 | |
| B. | 棉花、纸、醋酸纤维的主要成分都是纤维素 | |
| C. | 淀粉、牛油、蛋白质都是天然高分子化合物 | |
| D. | 变质的油脂有难闻的特殊气味,是由于油脂发生了水解反应 |

| A. | 头孢羟氨苄的化学式为C16H16N3O5S•H2O | |
| B. | 1mol头孢羟氨苄与NaOH溶液和浓溴水反应时,分别需要消耗NaOH 4mol和Br23mol | |
| C. | 在催化剂存在的条件下,1mol头孢羟氨苄消耗7molH2 | |
| D. | 头孢羟氨苄能在空气中稳定存在 |
 人们对苯的认识有一个不断深化的过程.
人们对苯的认识有一个不断深化的过程. )和石灰的混合物得到液体,命名为苯,写出苯甲酸钠与NaOH共热生成苯的化学方程式:
)和石灰的混合物得到液体,命名为苯,写出苯甲酸钠与NaOH共热生成苯的化学方程式: +NaOH$→_{△}^{氧化钙}$Na2CO3+
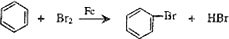
+NaOH$→_{△}^{氧化钙}$Na2CO3+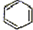 .
.
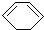 )脱
)脱