题目内容
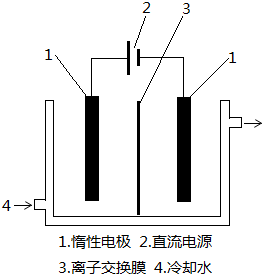
15.碘被称为“智力元素”,科学合理地补充碘可防止碘缺乏病.碘酸钾(KIO3)是国家规定的食盐加碘剂,它的晶体为白色,可溶于水.碘酸钾在酸性介质中与过氧化氢或碘化物作用均生成单质碘.以碘为原料,通过电解制备碘酸钾的实验装置如图所示.请回答下列问题:
(1)碘是紫黑色(填颜色)固体物质,实验室常用升华方法来分离提纯含有少量杂质的固体碘.
(2)写出碘酸钾在酸性介质中与过氧化氢反应的离子方程式:2IO3-+2H++5H2O2=I2↓+5O2↑+6H2O
(3)电解前,先将一定量的精制碘溶于过量氢氧化钾溶液,溶解时发生反应:3I2+6KOH═5KI+KIO3+3H2O,将该溶液加入阳极区.另将氢氧化钾溶液加入阴极区,电解槽用水冷却.图中的序号3应为阴离子交换膜(填“阳”或“阴”);电解时,阳极上发生反应的电极反应式为I-+6OH--6e-=IO3-+3H2O.
(4)教材中利用KI与空气的反应来探究反应速率与温度的关系,现有1mol/L的KI溶液、0.1mol/L的H2SO4溶液、淀粉溶液,则实验时这几种试剂的加入顺序为:KI溶液、淀粉溶液、0.1mol/L的H2SO4溶液;反应的离子方程式为4H++4I-+O2=2I2+2H2O.
(5)已知KI+I2?KI3,将I2溶于KI溶液,在低温条件下,可制得KI3•H2O.该物质作为食盐加碘剂是否合适?否(填“是”或“否”),并说明理由低温制备的KI3受热易分解为I2,而I2受热易升华.为了提高加碘盐(添加KI)的稳定性,可加稳定剂减少碘的损失.下列物质中有可能作为稳定剂的是AC.
A.Na2S2O3B.AlCl3C.Na2CO3D.NaNO2.
分析 (1)碘是紫黑色固体;加热时碘易升华.
(2)KIO3在酸性介质中与过氧化氢作用生成单质碘和氧气;
(3)电解时,阳极上发生氧化反应,碘离子在阳极上失去电子结合氢氧根生成碘酸根离子;
(4)KI溶液在硫酸提供的酸性环境下,被氧气氧化成单质碘;
(5)根据KI具有还原性及氧化还原反应、KI3在常温下不稳定性来分析;根据提高加碘盐(添加KI)的稳定性,主要是防止I- 被氧化来分析.
解答 解:(1)碘是紫黑色固体;加热条件下碘易升华,杂质不易升华,所以采用升华的方法分离碘单质,故答案为:紫黑色;升华;
(2)KIO3在酸性介质中与过氧化氢作用生成单质碘和氧气,+5价碘元素降低生成碘单质,-1价的氧升高生成氧气,该反应的离子反应方程式为2IO3-+2H++5H2O2=I2↓+5O2↑+6H2O,故答案为:2IO3-+2H++5H2O2=I2↓+5O2↑+6H2O;
(3)电解时,阳极上发生氧化反应,碘离子向阳极移动,在阳极上失去电子生成碘酸根离子,电极反应式为I-+6OH--6e-=IO3-+3H2O,所以阴极的阴离子氢氧根要移向阳极,所以图中的序号3应为阴离子交换膜,故答案为:阴;I-+6OH--6e-=IO3-+3H2O;
(4)KI溶液在硫酸提供的酸性环境下,被氧气氧化成单质碘,反应的离子方程式为:4H++4I-+O2=2I2+2H2O,故答案为:4H++4I-+O2=2I2+2H2O;
(5)KI作为加碘剂的食盐在保存过程中,KI会被空气中氧气氧化,KI在潮湿空气中氧化的反应化学方程式为:4KI+O2+2H2O═2I2+4KOH,根据题目告知,KI3•H2O是在低温条件下,由I2溶于KI溶液可制得.再由题给的信息:“KI+I2?KI3”,可知KI3在常温下不稳定性,低温条件下易分解为KI和I2,KI又易被空气中的氧气氧化,I2易升华,所以KI3•H2O作为食盐加碘剂是不合适的;
提高加碘盐(添加KI)的稳定性,主要是防止I- 被氧化,根据题给信息“还原性:S2O32->I-”和氧化还原反应的强弱规律,可以选Na2S2O3作稳定剂;又由题给信息“3I2+6OH-═IO3-+5I-+3H2O”,可知I2与OH-会发生反应生成IO3-和5I-,而Na2CO3水解呈碱性,因而也可以用Na2CO3作稳定剂,防止加碘盐(添加KI)在潮湿环境下被氧气氧化.至于AlCl3,水解后呈酸性,且还原性I->Cl-,所不能作稳定剂;NaNO2当遇强还原性物质时能表现出氧化性,则NaNO2与KI能发生氧化还原反应为2NO2-+2I-+4H+=2NO↑+I2+2H2O,所以不能作稳定剂,
故答案为:否;低温制备的KI3受热易分解为I2,而I2受热易升华;AC.
点评 本题考查了碘的物理性质、电解原理、碘离子的检验等性质,难度不大,明确酸性条件下碘离子和碘酸根离子能生成碘单质,碱性条件下,碘能和氢氧根离子生成碘离子和碘酸根离子.

| A. | 苯酚与氢氧化钠溶液反应 | |
| B. | 溴乙烷与NaOH溶液混和共热CH3CH2Br+NaOH$→_{△}^{水}$CH2═CH2↑+H2O+NaBr | |
| C. | 乙醛与银氨溶液反应 CH3CHO+2[Ag(NH3)2]OH$\stackrel{△}{→}$CH3COONH4+2Ag↓+3NH3+H2O | |
| D. | 乙醇的消去反应 CH3CH2OH$→_{170℃}^{浓硫酸}$CH2═CH2↑+H2O |
| A. | Ksp(AgI)>Ksp(AgCl) | |
| B. | 加过量KI溶液充分反应后,溶液中Ag+和I-的浓度之积大于Ksp(AgI) | |
| C. | 加过量KI溶液充分反应后,溶液中Ag+和Cl-的浓度之积大于Ksp(AgCl) | |
| D. | 以上结论都不正确 |
| A. | 原子半径:W>Z>Y>X>M | |
| B. | YM2、Y2X2、W2M2均为直线型的共价化合物 | |
| C. | 元素Z和元素M的最高正价的数值之和等于11 | |
| D. | 由X、Y、Z、M四种元素形成的化合物中可能含有离子键 |
| A. | pH值均为12的烧碱溶液与氢氧化钡溶液的物质的量浓度之比 | |
| B. | 硫化钾溶液中c(K+)与c(S2-)之比 | |
| C. | 相同温度下,0.2mol•L-1的醋酸溶液与0.1mol•L-1的醋酸溶液中的c(H+)之比 | |
| D. | 10mL 0.5mol•L-1的盐酸溶液与5mL 0.5mol•L-1的醋酸溶液中的n(H+)之比 |
| A. | 元素Y、Z、W形成的离子具有相同电子层结构,其离子半径依次增大 | |
| B. | 39g Z2Y2中含有的离子数约为1.204×1024 | |
| C. | 元素Z、R的氧化物的水化物之间相互反应生成的盐溶液一定呈中性 | |
| D. | 元素Y、R分别与元素X形成的化合物的热稳定性:XmY>XmR |
| A. | 加成→取代→取代→取代 | B. | 取代→加成→取代→取代 | ||
| C. | 取代→取代→加成→取代 | D. | 取代→取代→取代→加成 |
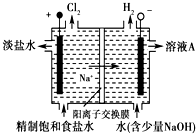 氯碱工业中电解饱和食盐水的原理示意图如图所示
氯碱工业中电解饱和食盐水的原理示意图如图所示