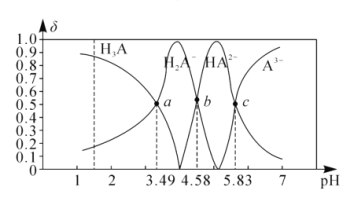
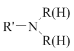题目内容
【题目】常见的太阳能电池有单晶硅太阳能电池、多晶硅太阳能电池、GaAs 太阳能电池及铜铟镓硒薄膜太阳能电池等。
(1)基态亚铜离子(Cu+)的价电子排布图为_________;高温下CuO 容易转化为Cu2O,试从原子结构角度解释原因:_____。
(2)镓、砷、硒三种元素位于第四周期,其第一电离能从大到小的顺序为_____(用元素符号表示)
(3)GaCl3和AsF3的立体构型分别是_____,_____。
(4)硼酸(H3BO3)本身不能电离出H+,在水中易结合一个OH-生成[B(OH)4]-,而体现弱酸性。
①[B(OH) 4]-中B 原子的杂化类型为_____。②[B(OH)4 ]-的结构式为_____。
(5)金刚石的晶胞如图,若以硅原子代替金刚石晶体中的碳原子,便得到晶体硅;若将金刚石晶体中一半的碳原子换成硅原子,且碳、硅原子交替,即得到碳化硅晶体(金刚砂)。

①金刚石、晶体硅、碳化硅的熔点由高到低的排列顺序是_____(用化学式表示);②金刚石的晶胞参数为a pm(1pm=10-12 m)。1cm3晶体的平均质量为_____g(只要求列算式,阿伏加德罗常数为NA)。
【答案】![]() Cu2O 中 Cu+的价层电子排布处于稳定的全充满状态 As>Se>Ga 平面三角形 三角锥型 sp3
Cu2O 中 Cu+的价层电子排布处于稳定的全充满状态 As>Se>Ga 平面三角形 三角锥型 sp3 ![]() C>SiC>Si
C>SiC>Si ![]()
【解析】
(1)基态铜 (Cu)的价电子排布式为3d104s1,其失去最外层1个电子后为亚铜离子(Cu+),排布式变为3d10,电子排布图为![]() ;亚铜离子(Cu+)价层电子排布处于全充满状态,较稳定,而铜离子价层电子排布为3d9,不稳定,故高温下CuO 容易转化为Cu2O;
;亚铜离子(Cu+)价层电子排布处于全充满状态,较稳定,而铜离子价层电子排布为3d9,不稳定,故高温下CuO 容易转化为Cu2O;
(2)镓、砷、硒三种元素分别位于第四周期IIIA族、VA族、VIA族,同周期从左到右元素的第一电离能呈增大趋势,但砷的4p能级处于半充满状态,As的第一电离能大于其相邻元素的第一电离能;
(3)用价层电子对互斥理论分析分子的构型;
(4)①[B(OH)4]-中的B原子上的孤电子对=![]() (a+1-bx)=
(a+1-bx)=![]() (3+1-4)=0,σ键电子对数为4,价层电子对数为4,则B 原子的杂化类型为sp3;
(3+1-4)=0,σ键电子对数为4,价层电子对数为4,则B 原子的杂化类型为sp3;
②其结构式为:![]() ;
;
(5)①金刚石、晶体硅、碳化硅均为原子晶体,共价键的键能与原子半径有关,原子半径越小共价键的键能越大,熔沸点越高,键能:C—C>C—Si>Si—Si,则熔点由高到低的排列顺序C>SiC>Si;
②金刚石的密度![]() =
=![]() 。
。
(1) 基态铜 (Cu)的价电子排布式为3d104s1,其失去最外层1个电子后为亚铜离子(Cu+),排布式变为3d10,电子排布图为![]() ;亚铜离子(Cu+)价层电子排布处于全充满状态,较稳定,而铜离子价层电子排布为3d9,不稳定,故高温下CuO 容易转化为Cu2O;则答案为Cu2O 中 Cu+的价层电子排布处于稳定的全充满状态;
;亚铜离子(Cu+)价层电子排布处于全充满状态,较稳定,而铜离子价层电子排布为3d9,不稳定,故高温下CuO 容易转化为Cu2O;则答案为Cu2O 中 Cu+的价层电子排布处于稳定的全充满状态;
(2)镓、砷、硒三种元素分别位于第四周期IIIA族、VA族、VIA族,同周期从左到右元素的第一电离能呈增大趋势,但砷的4p能级处于半充满状态,As的第一电离能大于其相邻元素的第一电离能,即第一电离能由大到小的顺序为As>Se>Ga;
(3)GaCl3中Ga上的孤电子对数为![]() ×(3-3×1)=0,σ键电子对数为3,价层电子对数为3,由于没有孤电子对,故其构型为平面三角形;AsF3中As上的孤电子对数为
×(3-3×1)=0,σ键电子对数为3,价层电子对数为3,由于没有孤电子对,故其构型为平面三角形;AsF3中As上的孤电子对数为![]() ×(5-3×1)=1,σ键电子对数为3,价层电子对数为4,由于含1对孤电子对,立体构型为三角锥型;;
×(5-3×1)=1,σ键电子对数为3,价层电子对数为4,由于含1对孤电子对,立体构型为三角锥型;;
(4)①[B(OH)4]-中的B原子上的孤电子对=![]() (a+1-bx)=
(a+1-bx)=![]() (3+1-4)=0,σ键电子对数为4,价层电子对数为4,则B 原子的杂化类型为sp3;
(3+1-4)=0,σ键电子对数为4,价层电子对数为4,则B 原子的杂化类型为sp3;
②其结构式为:![]() ;
;
(5)①金刚石、晶体硅、碳化硅均为原子晶体,共价键的键能与原子半径有关,原子半径越小共价键的键能越大,熔沸点越高,键能:C—C>C—Si>Si—Si,则熔点由高到低的排列顺序C>SiC>Si;
②金刚石的密度![]() =
=![]() ,1个金刚石晶胞中碳原子数=8
,1个金刚石晶胞中碳原子数=8![]() +6
+6![]() +4=8,体积V=a3 pm3=(a×10-10)3cm3,密度
+4=8,体积V=a3 pm3=(a×10-10)3cm3,密度![]() =
=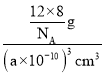 =
=![]() g/cm3,则1cm3晶体的平均质量为
g/cm3,则1cm3晶体的平均质量为![]() g。
g。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案