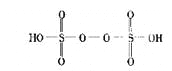
题目内容
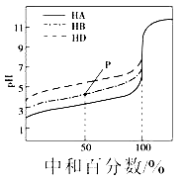
【题目】常温下取0.1mol/L的NaA和NaB两种盐溶液各1L,分别通入0.02molCO2,发生如下反应:NaA+CO2+H2O=HA+NaHCO3、2NaB+CO2+H2O=2HB+Na2CO3。且HA和HB的1L溶液分别加水稀释至体积为VL时可能有如下曲线,则下列说法正确的是

A.X是HA,M是HB
B.常温下pH:NaA溶液>NaB溶液
C.对于c(R-)/[c(HR)c(OH-)]的值(R代表A或B),一定存在HA>HB
D.若常温下浓度均为0.1mol/L的NaA和HA的混合溶液的pH>7,则c(A-)>c(HA)
【答案】C
【解析】已知:NaA+CO2+H2O=HA+NaHCO3、2NaB+CO2+H2O=2HB+Na2CO3,则酸性:H2CO3>HA>HCO3->HB,加水稀释,促进弱酸的电离,酸性越弱,溶液稀释时pH变化越小,所以加水稀释相同的倍数时,pH变化小的是HB,由图可知,Z为HB,Y为HA,
A.加水稀释相同的倍数时,酸溶液PH增大,pH变化小的是HB,Z为HB,故A错误;
B.酸性:H2CO3>HA>HCO3->HB,酸性越弱对应阴离子水解程度越大,减小越强,常温下pH:NaA溶液<NaB溶液,故B错误;
C.0.1mol/L的NaA和NaB两种盐溶液各1L,水解程度A-<B-,B-离子减少的多,则
![]() 一定存在HA>HB,故C正确;
一定存在HA>HB,故C正确;
D.若常温下浓度均为0.1mol/L的NaA和HA的混合溶液的pH>7,溶液显碱性说明A-离子水解程度大于HA电离程度,则c(A-)<c(HA),故D错误;故选C。

 全能练考卷系列答案
全能练考卷系列答案 一课一练课时达标系列答案
一课一练课时达标系列答案【题目】某温度下,0.200 molL-1的HA溶液与0.200 molL-1的NaOH溶液等体积混合后,所得溶液中部分微粒组分及浓度如下表,下列说法正确的是
微粒 | X | Y | Na+ | A- |
浓度/(mol·L-1) | 8.00 | 2.50 | 0.100 | 9.92 |
A.0.1mol·L-1HA溶液的pH=1 B.该温度下Kw=1.0![]() 10-14
10-14
C.微粒X表示OH-,Y表示H+ D.混合溶液中:n(A-)+n(X)=n(Na+)
【题目】【化学——选修5:有机化学基础】某抗结肠炎药物有效成分的合成路线如下(部分反应略去试剂和条件):
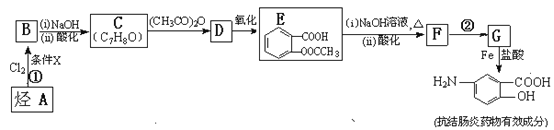
![]()
根据以上信息回答下列问题:
(1)烃A的结构简式是 。
(2)①的反应条件是 。②的反应类型是 。
(3)下列对抗结肠炎药物有效成分可能具有的性质推测正确的是: 。
A.水溶性比苯酚好,密度比苯酚的大 |
B.能发生消去反应 |
C.能发生聚合反应 |
D.既有酸性又有碱性 |
(4)E与足量NaOH溶液反应的化学方程式是 。
(5)写出所有符合下列条件的E的同分异构体的结构简式: 。
a.与E具有相同的官能团
b.苯环上的一硝基取代产物有两种
(6)已知![]() 易被氧化,苯环上连有烷基时再引入一个取代基,常取代在烷基的邻对位,而当苯环上连有羧基时则取代在间位。据此写出以A为原料合成化合物
易被氧化,苯环上连有烷基时再引入一个取代基,常取代在烷基的邻对位,而当苯环上连有羧基时则取代在间位。据此写出以A为原料合成化合物![]() 的合成路线 。(仿照题中抗结肠炎药物有效成分的合成路线的表达方式答题)
的合成路线 。(仿照题中抗结肠炎药物有效成分的合成路线的表达方式答题)