��Ŀ����
����Ŀ��ѡ������ѧ�����ʽṹ������](13��)
���������г��ù��������������ⶨ�����̵ĺ�����
��Ӧԭ��Ϊ: 2Mn2��+5S2O82-+8H2O![]() 2MnO4-+10SO42-+16H��
2MnO4-+10SO42-+16H��
��1����̬��ԭ�ӵĺ�������Ų�ʽΪ _
��2��������Ӧ�漰��Ԫ������ͬ����Ԫ�أ����һ�������ɴ�С��˳��Ϊ (��Ԫ�ط���)��
��3����֪H2��S2O8�Ľṹ��ͼ��
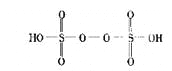
��H2��S2O8��ԭ�ӵĹ���ӻ���ʽΪ ��
��������Ӧ�б���ԭ��Ԫ��Ϊ ��
��������Ӧÿ����1 mol MnO4 -��S2O82- ���ѵĹ��ۼ����ͼ�����ĿΪ ��
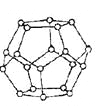
��4��һ�������£�ˮ���Ӽ��ͨ��OһH������O�������H2O���ӽ�ϳ���ά�Ǽܽṹ�����еĶ������Ѩ�пɰ�������С���ӣ��γ�����ˮ�ϰ����ᄃ��
����ͼ��һ����ˮ���ӹ��ɵ���ʮ������Ǽ�(��o����ʾˮ����)��������������Ϊ ;
��ʵ���ñ��������������Ϊ18��8ĿkJ��mol-1���������ۻ���Ϊ5��0kJ��mol-1����ԭ������� ��
���𰸡���1��1s22s22p63s23p63d54s2��2��O>S
��3����sp3�� S ���Ǽ��Լ� 2��5NA
��4����30 ��Һ̬ˮ����Ȼ���ڴ������
�������������������1������25��Ԫ�أ���̬��ԭ�ӵĺ�������Ų�ʽΪ1s22s22p63s23p63d54s2
��2��������Ӧ�漰��Ԫ������ͬ����Ԫ����O��S������ͬ����Ԫ�أ���һ�����ܴ��ϵ������μ�С�������һ�������ɴ�С��˳��ΪO>S��
��3����H2��S2O8��ԭ������ԭ���γ�4���������������ӻ���ʽΪsp3�ӻ�����������Ӧ����Ԫ�صĻ��ϼ���+2�����ߵ�+7�ۣ���ʧ���ӱ���������Ԫ�صĻ��ϼ���+7�۽��͵�+6�ۣ��õ��ӣ�����ԭ�����Ա���ԭ��Ԫ��ΪS ��������������Ӧ2Mn2��+5S2O82-+8H2O![]() 2MnO4-+10SO42-+16H��,ת��10e������֪ÿ����1 mol MnO4 -��S2O82- ���ѵĹ��ۼ�����Ϊ�Ǽ��Լ�������ĿΪ2��5NA��
2MnO4-+10SO42-+16H��,ת��10e������֪ÿ����1 mol MnO4 -��S2O82- ���ѵĹ��ۼ�����Ϊ�Ǽ��Լ�������ĿΪ2��5NA��
��4������ˮ���ӹ��ɵ���ʮ������Ǽܣ�ˮ��������Ϊ5/3��12=20��,ÿ��ˮ������һ����ԭ�ӣ�������ԭ�ӣ�ˮ���Ӽ��ͨ��OһH������O�������H2O���ӽ�ϳ���ά�Ǽܽṹ������������������Ϊ20��1��5=30����Һ̬ˮ����Ȼ���ڴ������������ʵ���ñ��������������Ϊ18��8ĿkJ��mol-1���������ۻ���Ϊ5��0kJ��mol-1��