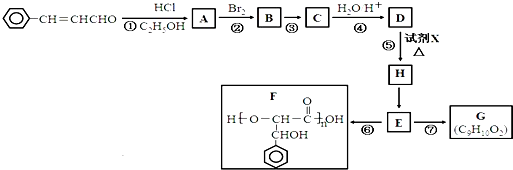
题目内容
某溶液中仅含有下表中的一些离子(不考虑水的电离和离子的水解)
为鉴定这些离子,取少量溶液加入稀HCl,有无色气体生成.该气体遇空气变为红棕色,且溶液中阴离子的种类不变;
(1)通过分析该实验,能确定溶液中一定存在的阳离子是 .一定存在的阴离子是 .
(2)写出实验中发生的离子方程式 .
(3)通过对实验的分析,尚不能确定溶液中是否存在的阴离子是 ,如何进一步鉴别该离子是否存在 .
| 阳离子 | Na+ Mg2+ Fe2+ Al3+ Fe3+ |
| 阴离子 | OH- Cl- CO32- NO3- SO42- |
(1)通过分析该实验,能确定溶液中一定存在的阳离子是
(2)写出实验中发生的离子方程式
(3)通过对实验的分析,尚不能确定溶液中是否存在的阴离子是
考点:离子共存问题
专题:离子反应专题
分析:取少量溶液加入稀HCl,有无色气体生成.该气体遇空气变为红棕色,且溶液中阴离子的种类不变,含有具有氧化性的NO3-和还原性的Fe2+,发生3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O,则阴离子OH-、CO32-一定不存在,阴离子种类不变,则原来不存在Cl-,不能确定是否含SO42-,以此来解答.
解答:
解:取少量溶液加入稀HCl,有无色气体生成.该气体遇空气变为红棕色,且溶液中阴离子的种类不变,含有具有氧化性的NO3-和还原性的Fe2+,发生3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O,则阴离子OH-、CO32-一定不存在,阴离子种类不变,则原来不存在Cl-,不能确定是否含SO42-,
(1)由上述分析可知,一定有阳离子为Fe2+,一定存在的阴离子是NO3-,故答案为:Fe2+;NO3-;
(2)发生的离子反应为3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O,故答案为:3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O;
(3)尚不能确定溶液中是否存在的阴离子是SO42-,鉴别方法为取少量原溶液,加盐酸后无现象再加氯化钡生成白色沉淀,可证明含有,否则不含,故答案为:SO42-;取少量原溶液,加盐酸后无现象再加氯化钡生成白色沉淀,可证明含有,否则不含.
(1)由上述分析可知,一定有阳离子为Fe2+,一定存在的阴离子是NO3-,故答案为:Fe2+;NO3-;
(2)发生的离子反应为3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O,故答案为:3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O;
(3)尚不能确定溶液中是否存在的阴离子是SO42-,鉴别方法为取少量原溶液,加盐酸后无现象再加氯化钡生成白色沉淀,可证明含有,否则不含,故答案为:SO42-;取少量原溶液,加盐酸后无现象再加氯化钡生成白色沉淀,可证明含有,否则不含.
点评:本题考查离子的共存,为高频考点,把握无色气体变化为红棕色及发生的离子反应为解答的关键,侧重复分解反应及氧化还原反应的离子共存考查,题目难度不大.

练习册系列答案
相关题目
下列各组离子,能在强酸溶液中大量共存,并且溶液呈无色透明的是( )
| A、K+、Na+、SO42-、MnO4- |
| B、Na+、K+、NO3-、I- |
| C、K+、Ca2+、SO42-、HCO3- |
| D、Mg2+、NH4+、NO3-、Cl- |
下列各溶液中NO3-物质的量浓度最大的是( )
| A、20mL 2mol/L Mg(NO3)2 |
| B、100mL 2.5mol/L NaNO3 |
| C、25mL 1.0mol/L Al(NO3)3 |
| D、30mL 2.5mol/L NH4NO3 |
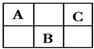 A、B、C为短周期元素,在周期表中所处的位置如图所示.A、C两元素的原子核外电子数之和等于B原子的质子数.B原子的原子核内质子数和中子数相等.
A、B、C为短周期元素,在周期表中所处的位置如图所示.A、C两元素的原子核外电子数之和等于B原子的质子数.B原子的原子核内质子数和中子数相等.