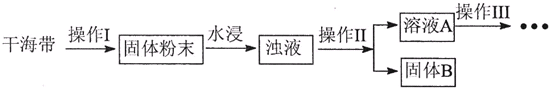
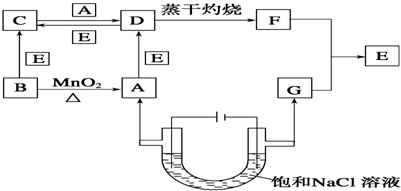
题目内容
下表为元素周期表的一部分,请参照元素①-⑧在表中的位置,用化学用语回答下列问题:
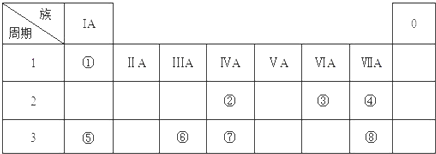
(1)④、⑤、⑥的原子半径由大到小的顺序为 ,②、⑦、⑧的最高价含氧酸的酸性由强到弱的顺序是 .
(2)由表中两种元素的原子按1:1组成的常见液态化合物含18个电子,该化合物的化学式 .
(3)工业上常采用电解A和冰晶石(Na3AlF6)混合物的方法冶炼制备⑥的单质,写出电解时的化学反应方程式: .
(4)甲、乙、丙是上述部分元素组成的双原子分子或负二价双原子阴离子,且甲、乙、丙的电子总数相等.甲是一种极强的氧化性单质.丙与⑤的阳离子可形成一种淡黄色固体B,该固体跟水反应可得到③的单质.则B中化学键的类型 ,乙的电子式 ,甲的组成元素的原子结构示意图 ,能证明甲的组成元素非金属性很强的事实 .(任举一例即可)

(1)④、⑤、⑥的原子半径由大到小的顺序为
(2)由表中两种元素的原子按1:1组成的常见液态化合物含18个电子,该化合物的化学式
(3)工业上常采用电解A和冰晶石(Na3AlF6)混合物的方法冶炼制备⑥的单质,写出电解时的化学反应方程式:
(4)甲、乙、丙是上述部分元素组成的双原子分子或负二价双原子阴离子,且甲、乙、丙的电子总数相等.甲是一种极强的氧化性单质.丙与⑤的阳离子可形成一种淡黄色固体B,该固体跟水反应可得到③的单质.则B中化学键的类型
考点:元素周期律和元素周期表的综合应用
专题:元素周期律与元素周期表专题
分析:根据元素在周期表中的位置知,①②③④⑤⑥⑦⑧分别是H、C、O、F、Na、Al、Si、Cl元素,
(1)原子的电子层数越多,其原子半径越大,同一周期元素中,原子半径随着原子序数增大而减小;元素的非金属性越强,其最高价氧化物是水化物酸性越强;
(2)由表中两种元素的原子按1:1组成的常见液态化合物含18个电子,该化合物为双氧水;
(3)工业上常常采用电解氧化铝的方法冶炼金属Al,电解氧化铝生成铝和氧气;
(4)甲、乙、丙是上述部分元素组成的双原子分子或负二价双原子阴离子,且甲、乙、丙的电子总数相等,甲是一种极强的氧化性单质,丙与⑤的阳离子可形成一种淡黄色固体B,B为Na2O2,则丙是O22-,丙含有18个电子,甲为双原子分子单质且具有强氧化性,则甲为F2,含有18电子且为双原子分子且含有表中元素的乙为HCl,结合物质性质解答.
(1)原子的电子层数越多,其原子半径越大,同一周期元素中,原子半径随着原子序数增大而减小;元素的非金属性越强,其最高价氧化物是水化物酸性越强;
(2)由表中两种元素的原子按1:1组成的常见液态化合物含18个电子,该化合物为双氧水;
(3)工业上常常采用电解氧化铝的方法冶炼金属Al,电解氧化铝生成铝和氧气;
(4)甲、乙、丙是上述部分元素组成的双原子分子或负二价双原子阴离子,且甲、乙、丙的电子总数相等,甲是一种极强的氧化性单质,丙与⑤的阳离子可形成一种淡黄色固体B,B为Na2O2,则丙是O22-,丙含有18个电子,甲为双原子分子单质且具有强氧化性,则甲为F2,含有18电子且为双原子分子且含有表中元素的乙为HCl,结合物质性质解答.
解答:
解:根据元素在周期表中的位置知,①②③④⑤⑥⑦⑧分别是H、C、O、F、Na、Al、Si、Cl元素,
(1)原子的电子层数越多,其原子半径越大,同一周期元素中,原子半径随着原子序数增大而减小,所以④、⑤、⑥的原子半径由大到小的顺序为⑤>⑥>④;元素的非金属性越强,其最高价氧化物是水化物酸性越强,非金属性⑧>②>⑦,其最高价氧化物是水化物酸性强弱顺序是,故答案为:⑤>⑥>④;⑧>②>⑦;
(2)由表中两种元素的原子按1:1组成的常见液态化合物含18个电子,该化合物为双氧水,化学式为H2O2,故答案为:H2O2;
(3)工业上常常采用电解氧化铝的方法冶炼金属Al,电解氧化铝生成铝和氧气,电解方程式为:2Al2O3
4Al+3O2↑,故答案为:2Al2O3
4Al+3O2↑;
(4)甲、乙、丙是上述部分元素组成的双原子分子或负二价双原子阴离子,且甲、乙、丙的电子总数相等,甲是一种极强的氧化性单质,丙与⑤的阳离子可形成一种淡黄色固体B,B为Na2O2,则丙是O22-,丙含有18个电子,甲为双原子分子单质且具有强氧化性,则甲为F2,含有18电子且为双原子分子且含有表中元素的乙为HCl,
B中化学键的类型为离子键和共价键,乙的电子式为 ,甲的组成元素的原子结构示意图
,甲的组成元素的原子结构示意图  ,能证明甲的组成元素非金属性很强的事实为氟气和氢气在黑暗处能产生爆炸,
,能证明甲的组成元素非金属性很强的事实为氟气和氢气在黑暗处能产生爆炸,
故答案为:离子键和共价键; ;
; ;氟气和氢气在黑暗处能产生爆炸.
;氟气和氢气在黑暗处能产生爆炸.
(1)原子的电子层数越多,其原子半径越大,同一周期元素中,原子半径随着原子序数增大而减小,所以④、⑤、⑥的原子半径由大到小的顺序为⑤>⑥>④;元素的非金属性越强,其最高价氧化物是水化物酸性越强,非金属性⑧>②>⑦,其最高价氧化物是水化物酸性强弱顺序是,故答案为:⑤>⑥>④;⑧>②>⑦;
(2)由表中两种元素的原子按1:1组成的常见液态化合物含18个电子,该化合物为双氧水,化学式为H2O2,故答案为:H2O2;
(3)工业上常常采用电解氧化铝的方法冶炼金属Al,电解氧化铝生成铝和氧气,电解方程式为:2Al2O3
| ||
| 冰晶石 |
| ||
| 冰晶石 |
(4)甲、乙、丙是上述部分元素组成的双原子分子或负二价双原子阴离子,且甲、乙、丙的电子总数相等,甲是一种极强的氧化性单质,丙与⑤的阳离子可形成一种淡黄色固体B,B为Na2O2,则丙是O22-,丙含有18个电子,甲为双原子分子单质且具有强氧化性,则甲为F2,含有18电子且为双原子分子且含有表中元素的乙为HCl,
B中化学键的类型为离子键和共价键,乙的电子式为
 ,甲的组成元素的原子结构示意图
,甲的组成元素的原子结构示意图  ,能证明甲的组成元素非金属性很强的事实为氟气和氢气在黑暗处能产生爆炸,
,能证明甲的组成元素非金属性很强的事实为氟气和氢气在黑暗处能产生爆炸,故答案为:离子键和共价键;
 ;
; ;氟气和氢气在黑暗处能产生爆炸.
;氟气和氢气在黑暗处能产生爆炸.
点评:本题考查了元素周期表和元素周期律的综合应用,根据物质结构、性质结合元素周期律分析解答,注意冶炼铝不能用电解氯化铝的方法,因为熔融状态下氯化铝不导电,为易错点.

练习册系列答案
 天天练口算系列答案
天天练口算系列答案
相关题目
下列各组离子在指定溶液中能大量共存的是( )
| A、加入稀硝酸的溶液:K+、Cl-、HS-、SO32- |
| B、加入FeCl3溶液:I-、NH4+、Cl、Ba2+ |
| C、加入NaOH的溶液:Na+、AlO2-、CO32-、K+ |
| D、无色pH=12的溶液:Fe3+、Mg2+、Al3+、NO3- |
为了使氯乙烷的水解反应进行比较完全,水解时需加入( )
| A、NaCl |
| B、NaHSO4 |
| C、NaOH |
| D、乙醇 |
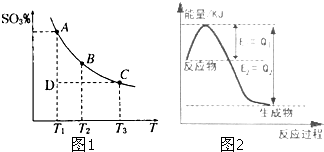 运用化学反应原理研究元素及其化合物的反应有重要意义.
运用化学反应原理研究元素及其化合物的反应有重要意义.