题目内容
写出下列反应的方程式或离子方程式.
(1)写出实验室制备氯气的离子方程式 .
(2)向水玻璃中通入足量CO2的离子方程式 .
(3)在FeCl2溶液中滴入氨水并放置一段时间,发现溶液中的白色沉淀迅速变为灰绿色,最终变成了红褐色.写出该变化的化学反应方程式 .
(4)FeCl2能否通过化合反应来制取,若不能,写出不能制备的理由;若能,写出反应的离子方程式 .
(5)实验室中保存NaOH溶液的试剂瓶不宜采用磨口玻璃塞,是因为(用化学方程式表示) .
(1)写出实验室制备氯气的离子方程式
(2)向水玻璃中通入足量CO2的离子方程式
(3)在FeCl2溶液中滴入氨水并放置一段时间,发现溶液中的白色沉淀迅速变为灰绿色,最终变成了红褐色.写出该变化的化学反应方程式
(4)FeCl2能否通过化合反应来制取,若不能,写出不能制备的理由;若能,写出反应的离子方程式
(5)实验室中保存NaOH溶液的试剂瓶不宜采用磨口玻璃塞,是因为(用化学方程式表示)
考点:离子方程式的书写
专题:离子反应专题
分析:(1)实验室利用二氧化锰与浓盐酸反应制取氯气;
(2)水玻璃为硅酸钠的水溶液,硅酸钠与足量二氧化碳反应生成硅酸沉淀和碳酸氢钠;
(3)发生Fe(OH)2与氧气、水的反应,生成氢氧化铁;
(4)铁与氯化铁反应生成氯化亚铁,可以通过化合反应获得氯化亚铁;
(5)玻璃塞的主要成分为二氧化硅,氢氧化钠溶液能够与二氧化硅反应生成硅酸钠,硅酸钠具有粘性,能够将玻璃塞和玻璃瓶粘在一起,据此进行解答.
(2)水玻璃为硅酸钠的水溶液,硅酸钠与足量二氧化碳反应生成硅酸沉淀和碳酸氢钠;
(3)发生Fe(OH)2与氧气、水的反应,生成氢氧化铁;
(4)铁与氯化铁反应生成氯化亚铁,可以通过化合反应获得氯化亚铁;
(5)玻璃塞的主要成分为二氧化硅,氢氧化钠溶液能够与二氧化硅反应生成硅酸钠,硅酸钠具有粘性,能够将玻璃塞和玻璃瓶粘在一起,据此进行解答.
解答:
解:(1)二氧化锰与浓盐酸反应生成氯化锰、氯气和水,反应的离子方程式为:MnO2+4H++2Cl-
Mn2++Cl2↑+2H2O,
故答案为:MnO2+4H++2Cl-
Mn2++Cl2↑+2H2O;
(2)硅酸钠与过量二氧化碳反应生成硅酸和碳酸氢钠,反应的离子方程式为:SiO32-+2H2O+2CO2=H2SiO3↓+2HCO3-,
故答案为:SiO32-+2H2O+2CO2=H2SiO3↓+2HCO3-;
(3)在FeCl2溶液中滴入氨水并放置一段时间,发现溶液中的白色沉淀迅氢氧化亚铁速变为灰绿色,最终变成了红褐色的氢氧化铁,反应的离子方程式为:4Fe(OH)2+O2+2H2O=4Fe(OH)3,
故答案为:4Fe(OH)2+O2+2H2O=4Fe(OH)3;
(4)发生Fe(OH)2与氧气、水的反应,生成氢氧化铁,该反应为4Fe(OH)2+O2+2H2O=4Fe(OH)3,故答案为:4Fe(OH)2+O2+2H2O=4Fe(OH)3;
(5)二氧化硅能够与氢氧化钠溶液发生反应:SiO2+2NaOH═Na2SiO3+H2O;由于玻璃塞的主要成分为二氧化硅,二氧化硅能够与氢氧化钠溶液反应生成具有粘性的硅酸钠,将玻璃塞和玻璃瓶粘在一起,所以不能使用玻璃塞的试剂瓶盛放氢氧化钠溶液,可以使用橡胶塞或者软木塞,
故答案为:SiO2+2NaOH═Na2SiO3+H2O.
| ||
故答案为:MnO2+4H++2Cl-
| ||
(2)硅酸钠与过量二氧化碳反应生成硅酸和碳酸氢钠,反应的离子方程式为:SiO32-+2H2O+2CO2=H2SiO3↓+2HCO3-,
故答案为:SiO32-+2H2O+2CO2=H2SiO3↓+2HCO3-;
(3)在FeCl2溶液中滴入氨水并放置一段时间,发现溶液中的白色沉淀迅氢氧化亚铁速变为灰绿色,最终变成了红褐色的氢氧化铁,反应的离子方程式为:4Fe(OH)2+O2+2H2O=4Fe(OH)3,
故答案为:4Fe(OH)2+O2+2H2O=4Fe(OH)3;
(4)发生Fe(OH)2与氧气、水的反应,生成氢氧化铁,该反应为4Fe(OH)2+O2+2H2O=4Fe(OH)3,故答案为:4Fe(OH)2+O2+2H2O=4Fe(OH)3;
(5)二氧化硅能够与氢氧化钠溶液发生反应:SiO2+2NaOH═Na2SiO3+H2O;由于玻璃塞的主要成分为二氧化硅,二氧化硅能够与氢氧化钠溶液反应生成具有粘性的硅酸钠,将玻璃塞和玻璃瓶粘在一起,所以不能使用玻璃塞的试剂瓶盛放氢氧化钠溶液,可以使用橡胶塞或者软木塞,
故答案为:SiO2+2NaOH═Na2SiO3+H2O.
点评:本题考查离子反应方程式和化学反应方程式的书写,为高频考点,题目难度中等,把握发生的化学反应及离子反应的书写方法为解答的关键,

练习册系列答案
相关题目
选取萃取剂将碘水中的碘萃取出来,下列物质不能作为萃取剂是( )
| A、CCl4 |
| B、酒精 |
| C、直馏汽油 |
| D、苯 |
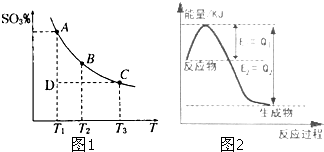 运用化学反应原理研究元素及其化合物的反应有重要意义.
运用化学反应原理研究元素及其化合物的反应有重要意义.