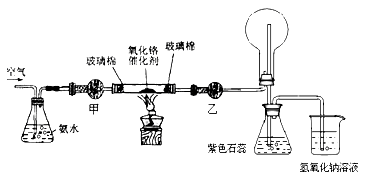
题目内容
【题目】球墨铸铁中含有一种铁碳化合物X。实验室测定化合物X的组成实验如下:下列说法不正确的是

A. 固体2是氧化铁
B. X与足量的热浓硝酸反应可能有NO2和CO2生成
C. 溶液甲中可能含有Fe3+
D. X的化学式可以表示为Fe3C2
【答案】D
【解析】铁碳化合物X,在足量空气中煅烧得固体1为铁的氧化物,可以有+2价或+3价的铁,溶于盐酸所得溶液中可能有Fe2+和Fe3+,再通入足量的氯气,溶液中都为+3价的铁,加热蒸发,铁离子水解,生成氢氧化铁,灼烧后氢氧化铁分解得固体2为氧化铁,24g氧化铁中含有铁元素的质量为112/160×24g=16.8g,利用元素守恒,可计算得化合物X中铁元素的质量也是16.8g,物质的量是0.3mol。进而求得X中碳元素的质量为18g-16.8g=1.2g,物质的量是0.1mol,所以在X中铁、碳原子的物质的量之比为3:1,因此X的化学式为Fe3C,Fe3C与热的浓硝酸发生氧化还原反应,碳元素可被氧化成二氧化碳,硝酸中的氮可被还原成二氧化氮,因此根据上面的分析可知,A、固体2是氧化铁,A正确;B、X与足量的热浓硝酸反应有NO2和CO2生成,B正确;C、溶液甲中可能含有Fe3+,故C正确;D、X的化学式可以表示为Fe3C,D错误;答案选D。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目