��Ŀ����
25��ʱ����Ũ��Ϊ0.1000 mol��L��1��NaOH��Һ�ζ�20.00 mLŨ�� ��Ϊ0.1000 mol��L��1��������HX��HY��HZ�ζ�������ͼ��ʾ������˵����ȷ����
| A������ͬ�¶��£�ͬŨ�ȵ���������Һ�ĵ�������˳��HZ��HY��HX |
| B�����ݵζ����ߣ��ɵ�Ka(HY)��10��5 |
| C��������HX��HY��Һ�������Ϻ���NaOH��Һ�ζ���HXǡ����ȫ��Ӧʱ�� c(X��)��c(Y��)��c(OH��)��c(H��) |
D��HY��HZ��ϣ��ﵽƽ��ʱ��c(H��)�� ��c(Z��)��c(OH��) ��c(Z��)��c(OH��) |
B
�������������Ũ�Ⱦ�Ϊ0.1000 mol/L��������HX��HY��HZ�����ݵζ�����0���������pH�ɵõ�HZ��
ǿ�ᣬHY��HX�����ᣬ�����ԣ�HY��HX��Aѡ�ͬ��ͬŨ��ʱ��������ĵ����ԣ�HZ��HY��
HX��Bѡ���NaOH��Һ�μӵ�10 mLʱ����Һ��c(HY)��c(Y��)����Ka(HY)��c(H+)=10��pH=10��5��
Cѡ���NaOH��Һ�ζ���HXǡ����ȫ��Ӧʱ��HY�类��ȫ�кͣ�������Һ��NaY��NaX���
��Һ���������ԣ�HY��HX����X����ˮ��̶ȴ���Y������Һ��c(Y��)��c(X��)��Dѡ�HY��HZ��
�ϣ���Һ�ĵ���غ�ʽΪ��c(H+)= c(Y��)+ c(Z��) +c(OH��)���ָ���HY�ĵ���ƽ�ⳣ����
Ka(HY)= ����c(Y��)=
����c(Y��)=
���Դ�ƽ���c(H+)= + c(Z��) +c(OH��)
+ c(Z��) +c(OH��)
���㣺������Һ��������⣬�漰��pHֵ����Һϡ�͵�������⡣

 �����ҵ���������ϵ�д�
�����ҵ���������ϵ�д�̼�����������볣��Ki1��Ki2���ֱ��Ӧ̼����������롣����Ki1��Ki2˵����ȷ����
A��Ki1�ı���ʽΪ |
B��Ki2��Ӧ�ĵ��������HCO3�� + H2O 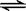 H3O+ + CO32�� H3O+ + CO32�� |
| C����̼��ĵ���ƽ�������ƶ�ʱ��Ki1��Ki2����Ӧ���� |
| D���ı�����ʹKi1��С����Ki2һ��Ҳ��С |
�����й���Һ��˵����ȷ����
| A����10mLpH=3�ĺ�����Һ�м���10mLpH=l1��NaOH��Һ�����Һ��pH=7 |
| B��ʵ��ⶨNH4HCO3��Һ�Լ��ԣ�CH3COONH4��Һ�����ԣ�˵������CH3COOH>HCO3 |
| C��NH4CI��Һ��ˮϡ������c��H+��+c��NH3��H2O��=c��OHһ�� |
| D����AgI�����м��˱���KCl��Һ���а�ɫ�������ɣ�˵��AgCl��AgI������ |
��20mL 0.5mol/L�Ĵ�����Һ����μ�������ʵ���Ũ�ȵ��ռ���Һ���ⶨ�����Һ���¶ȱ仯��ͼ��ʾ�����й��ڻ����Һ�����˵���������
| A������ĵ���ƽ�ⳣ����b�㣾a�� |
| B����ˮ�������c(OH��)��b�㣾c�� |
| C����a�㵽b�㣬�����Һ�п��ܴ��ڣ�c(CH3COO��)= c(Na+) |
| D��b�㵽c�㣬�����Һ��һֱ���ڣ�c(Na+)��c(CH3COO��)��c(OH��)��c(H+) |
��֪H2CO3������ǿ��H2S����amol��L -1 NaHS��bmol��L-1NaOH����ϡ��Һ��������(a>0��b>0)��������Һ����������ʵ���Ũ�ȹ�ϵ��ȷ����
| A��a=bʱ��c(OH-)= c(H+)+c(HS-) |
| B��a=2bʱ��c(S2-)>c(HS )>c(OH-)>c(H+) |
| C��a=3bʱ��c(Na+)+c(H+)=2c(S2-)+c(HS-)+c(OH-) |
| D��a=4bʱ��4c(Na+)=5c(S2-)+5c(HS-)5c(H2S) |
���ڳ�����pH = 12��NaOH��Һ������˵���������
| A��c(OH��) =c(Na+) + c(H+) |
| B����ˮ�������c(OH��) = 1.0��10��12 mol��L��1 |
| C��������pH = 2�Ĵ����Ϻ�������Һ�Լ��� |
| D��������0.01 mol��L��1�Ȼ����Һ��Ϻ�������Һ�У�c(Na+)> c(NH4+) |
25��ʱ��0.1 mol Na2CO3�����������õ�һ�����Ϊ1 L����Һ����Һ�в�������pH �Ĺ�ϵ��ͼ��ʾ�������й���Һ������Ũ�ȹ�ϵ������ȷ����
| A��W����ʾ����Һ�У�c(Na+)+ c(H+)=2c(CO32��)+ c(OH��)+ c(Cl��) |
| B��pH=4����Һ�У�c(H2CO3)+ c(HCO3��)+ c(CO32��)<0.1 mol��L��1 |
| C��pH=8����Һ�У�c(H+)+ c(H2CO3)+ c(HCO3��) = c(OH��)+c(Cl��) |
| D��pH=11����Һ�У�c(Na+)>c(Cl��)>c(CO32��)>c(HCO3��)>c(H2CO3) |
�����£���V1mL c1mol/L�Ĵ���μӵ�V2mL c2mol/L������������Һ�У����н�����ȷ����
| A������c1mol/L�Ĵ����ϡ10��������pH����1 |
| B������c2 mol/L������������Һ��ϡ10��������pH��С1 |
| C����c1? V1=c2?V2������Һ��c(CH3COO��)=c(Na+) |
| D�������Һ��pH=7������Һ��c(CH3COO��)=c(Na+) |
����˵���У���ȷ���ǣ� ��
| A����ͭ����ʱ����������0.5molCu2+��������NA��Cuԭ������ |
| B����Ϊ����H2SO3��H2CO3������S�õ�����������C |
| C����ͨ���Ƚ�Mg��OH��2��MgCO3��Ksp�Ĵ�С �Ƚ����ǵ��ܽ��� |
| D����0.1molNaClO����Һ���ɿɵ�5.85gNaCl���� |