题目内容
碳酸有两个电离常数Ki1、Ki2,分别对应碳酸的两步电离。关于Ki1和Ki2说法正确的是
A.Ki1的表达式为 |
B.Ki2对应的电离过程是HCO3— + H2O 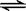 H3O+ + CO32— H3O+ + CO32— |
| C.当碳酸的电离平衡正向移动时,Ki1与Ki2均相应增大 |
| D.改变条件使Ki1减小,则Ki2一定也减小 |
BD
解析试题分析:A、电离平衡常数是指弱电解质达到电离平衡时,生成物离子的浓度幂之积和反应物浓度的幂之积的比值,所以Ki1的表达式为 ,A不正确;B、Ki2对应的电离过程是HCO3— + H2O
,A不正确;B、Ki2对应的电离过程是HCO3— + H2O 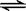 H3O+ + CO32—,可以简写为Ki2对应的电离过程是HCO3—
H3O+ + CO32—,可以简写为Ki2对应的电离过程是HCO3— 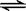 H+ + CO32—,B正确;C、电离平衡常数只与温度有关系,温度不变,平衡常数不变,C不正确;D、电离时吸热的,改变条件使Ki1减小,则改变的条件一定是降低温度,所以Ki2一定也减小,D正确,答案选BD。
H+ + CO32—,B正确;C、电离平衡常数只与温度有关系,温度不变,平衡常数不变,C不正确;D、电离时吸热的,改变条件使Ki1减小,则改变的条件一定是降低温度,所以Ki2一定也减小,D正确,答案选BD。
考点:考查外界条件对电离平衡以及电离平衡常数的影响

练习册系列答案
 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案
相关题目
用标准盐酸滴定未知浓度的NaOH溶液,下列各操作中,不会引起实验误差的是
| A.用蒸馏水冼净滴定管后,装入标准盐酸进行滴定 |
| B.用蒸馏水冼净锥形瓶后,再用NaOH液润洗,而后装入一定体积的NaOH溶液 |
| C.用甲基橙做指示剂,当溶液由黄色变成橙色,立刻读数盐酸体积。 |
| D.用碱式滴定管取10.00 mLNaOH溶液放入用蒸馏水洗净的锥形瓶中,再加入适量蒸馏水进行滴定 |
将氯化铵固体溶解在D2O(重水)中,反应的离子方程式正确的是
A.NH4+ + D2O  NH3·D2O + H+ NH3·D2O + H+ | B.NH4+ + D2O  NH3·HDO + D+ NH3·HDO + D+ |
C.NH4+ + 2D2O  NH3·HDO + D3O+ NH3·HDO + D3O+ | D.NH4+ + 2D2O  NH3·D2O + HD2O+ NH3·D2O + HD2O+ |
工业上用Na2CO3溶液浸泡锅炉水垢使其中CaSO4能转化为CaCO3,下列有关CaSO4和CaCO3性质有关推测正确的是
| A.CaSO4是一种强酸弱碱盐 |
| B.CaSO4溶解度小于CaCO3 |
| C.CaSO4溶解度大于CaCO3 |
| D.CaSO4溶解度等于CaCO3 |
常温下,对下列四种溶液的叙述正确的是
| | ① | ② | ③ | ④ |
| pH | 12 | 12 | 2 | 2 |
| 溶液 | 氨水 | 氢氧化钠溶液 | 醋酸溶液 | 盐酸 |
A.③、④两溶液相比,两者的KW相同
B.①、②两种溶液分别加水稀释100倍,pH变化较大的是①
C.等体积的③、④溶液中分别加入过量锌粒,产生的氢气前者大于后者
D.①、④ 两溶液按2: 1体积比混合后溶液中微粒浓度满足c(NH4+)+c(NH3·H2O)=c(Cl-)
常温下,0.1mol/L HX的pH=1,0.1 mol/LCH3COOH的pH=2.9。下列说法中不正确的是
| A.HX和CH3COOH均可抑制水的电离 |
| B.将HCl与HX各0.1mol溶于水配成1L混合溶液,则溶液的c(H+)="0.2" mol/L |
| C.等物质的量浓度等体积的HX与CH3COONa两溶液混合后所得溶液中: c(Na+)>c(CH3COOH)>c(CH3COO-)>c(H+)>c(OH-) |
| D.向等浓度等体积的HX和CH3COOH溶液中,分别加入同浓度的NaOH溶液,欲使两者pH均等于7,则消耗氢氧化钠溶液的体积前者大于后者 |
下列说法或表述正确的是
| A.由水电离产生的c(H+)=1×10-2mol?L-1溶液中,可能存在:CO32-、NH4+、Cl-、Na+ |
| B.某醋酸稀溶液的pH=a,将此溶液稀释1倍后,溶液的pH=b,则a>b |
| C.Ba(OH)2溶液中加人过量的Al2(SO4)3溶液,其离子方程式为: 3Ba2++6OH- +2Al3++3SO42-=3BaS04↓+2Al(OH)3↓ |
| D.物质的量浓度均为1 mol?L-1的NaCl和MgCl2混合液中,含有Cl-的数目为3NA(NA表示阿伏加德罗常数的值) |
25℃时,用浓度为0.1000 mol·L-1的NaOH溶液滴定20.00 mL浓度 均为0.1000 mol·L-1的三种酸HX、HY、HZ滴定曲线如图所示。下列说法正确的是
| A.在相同温度下,同浓度的三种酸溶液的导电能力顺序:HZ<HY<HX |
| B.根据滴定曲线,可得Ka(HY)≈10-5 |
| C.将上述HX、HY溶液等体积混合后,用NaOH溶液滴定至HX恰好完全反应时: c(X-)>c(Y-)>c(OH-)>c(H+) |
D.HY与HZ混合,达到平衡时:c(H+)= +c(Z-)+c(OH-) +c(Z-)+c(OH-) |