题目内容
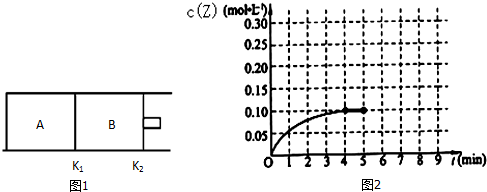
10. 在密闭容器中,将起始浓度均为2mol/L的CO和H2O混合加热到400℃,发生下列反应:CO(g)+H2O(g)?CO2(g)+H2(g),一段时间后该反应达到平衡,测得CO的浓度为0.5mol/L,则:
在密闭容器中,将起始浓度均为2mol/L的CO和H2O混合加热到400℃,发生下列反应:CO(g)+H2O(g)?CO2(g)+H2(g),一段时间后该反应达到平衡,测得CO的浓度为0.5mol/L,则:(1)平衡时CO的转化率为75%;该反应在该温度时的化学平衡常数为9.
(2)在相同的条件下,如果H2O和CO的起始浓度变为4mol/L,则CO的转化率为75%.
(3)800℃时,该反应的平衡常数为1,则该反应的△H< 0(填>,<,=)
(4)改变起始条件,在一体积为10L的容器中,通入一定量的CO和H2O,在850℃时发生上述反应,CO和H2O浓度变化如图,则0~4min的平均反应速率v(CO)=0.03mol/(L•min)
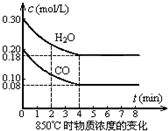
(5)t℃(高于850℃)时,在相同容器中发生上述反应,容器内各物质的浓度变化如表:
t℃时物质浓度(mol/L)的变化
| 时间(min) | CO | H2O | CO2 | H2 |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | C1 | C2 | C3 | C3 |
| 4 | C1 | C2 | C3 | C3 |
| 5 | 0.116 | 0.216 | 0.084 | 0.104 |
| 6 | 0.096 | 0.266 | 0.104 |
②反应在4min~5min问,平衡向逆方向移动,可能的原因是D(单选),
表中5min~6min之间数值发生变化,可能的原因是A(单选).
A.增加水蒸气 B.降低温度 C.使用催化剂 D.增加氢气浓度.
分析 在密闭容器中,将起始浓度均为2mol/L的CO和H2O混合加热到400℃,一段时间后该反应达到平衡,测得CO的浓度为0.5mol/L,则:
CO(g)+H2O(g)?CO2(g)+H2(g)
开始浓度(mol/L):2 2 0 0
变化浓度(mol/L):1.5 1.5 1.5 1.5
平衡浓度(mol/L):0.5 0.5 1.5 1.5
(1)CO转化率=$\frac{CO浓度变化量}{CO起始浓度}$×100%;平衡常数K=$\frac{c(C{O}_{2})×c({H}_{2})}{c(CO)×c({H}_{2}O)}$;
(2)在相同的条件下,如果H2O和CO的起始浓度变为4mol/L,等效为在原平衡基础上增大压强,平衡不移动,CO转化率与原平衡相同;
(3)800℃时该反应的平衡常数为1,小于400℃时的平衡常数K=9,说明升高温度平衡逆向移动,则正反应为放热反应;
(4)由图可知,0~4min内CO浓度变化量为(0.2-0.08)mol/L=0.12mol/L,再根据v=$\frac{△c}{△t}$计算v(CO);
(5)①3min、4min时相同物质的浓度相等,处于平衡状态;
起始浓度与(4)中相同,而(4)中850℃平衡时CO浓度为0.08mol/L,正反应为放热反应,升高温度平衡逆向移动,故该温度下平衡时CO的浓度比原平衡850℃大;
②反应中△c(CO)=△c(H2O)=△c(CO2)=△c(H2),由表中数据可知,5min时与开始相比CO、H2O、CO2的浓度变化之比为1:1:1,平衡向逆反应移动,故可能升高温度、降低压强或增大氢气的浓度;
表中5min-6min之间,CO浓度降低0.02mol/L、H2O的浓度增大0.05mol/L、CO2的浓度增大0.02mol/L,故应该是增大水蒸气的浓度.
解答 解:在密闭容器中,将起始浓度均为2mol/L的CO和H2O混合加热到400℃,一段时间后该反应达到平衡,测得CO的浓度为0.5mol/L,则:
CO(g)+H2O(g)?CO2(g)+H2(g)
开始浓度(mol/L):2 2 0 0
变化浓度(mol/L):1.5 1.5 1.5 1.5
平衡浓度(mol/L):0.5 0.5 1.5 1.5
(1)CO转化率=$\frac{1.5mol/L}{2mol/L}$×100%=75%;
平衡常数K=$\frac{c(C{O}_{2})×c({H}_{2})}{c(CO)×c({H}_{2}O)}$=$\frac{1.5×1.5}{0.5×0.5}$=9,
故答案为:75%;9;
(2)在相同的条件下,如果H2O和CO的起始浓度变为4mol/L,等效为在原平衡基础上增大压强,平衡不移动,CO转化率与原平衡相同为75%,故答案为:75%;
(3)800℃时该反应的平衡常数为1,小于400℃时的平衡常数,说明升高温度平衡逆向移动,则正反应为放热反应,故△H<0,故答案为:<;
(4)改变起始条件,在一体积为10L的容器中,通入一定量的CO和H2O,在850℃时发生上述反应,CO和H2O浓度变化如图,
由图可知,0~4min内CO浓度变化量为(0.2-0.08)mol/L=0.12mol/L,则v(CO)=$\frac{0.12mol/L}{4min}$=0.03mol/(L.min),故答案为:0.03;
(3)①由表中数据可知,3min、4min时都应个组分的浓度相同,故处于平衡状态,
该反应正反应是放热反应,升高温度平衡向逆反应移动,故该温度下平衡时CO的浓度比原平衡850℃大,
故答案为:平衡,大于;
②反应中△c(CO)=△c(H2O)=△c(CO2)=△c(H2),由表中数据可知,5min时与开始相比CO、H2O、CO2的浓度变化之比为1:1:1,平衡向逆反应移动,故可能升高温度、降低压强或增大氢气的浓度,故选D;
表中5min-6min之间,CO浓度降低0.02mol/L、H2O的浓度增大0.05mol/L、CO2的浓度增大0.02mol/L,故应该是增大水蒸气的浓度,故选A,
故答案为:D;A.
点评 考查考查化学平衡计算与影响因素、化学平衡常数及影响因素、化学平衡图象等,难度中等,(3)中注意分析各物质的浓度变化量关系判断改变条件.

| A. | 57g | B. | 57g/mol | C. | 74g | D. | 74g/mol |
| A. | 原混合气体的体积为1.2V L | B. | 原混合气体的体积为1.1V L | ||
| C. | 反应达平衡时气体A消耗掉0.05V L | D. | 反应达平衡时气体B消耗掉0.05V L |
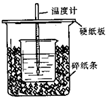 测定稀硫酸和稀氢氧化钠中和热的实验装置如图所示.
测定稀硫酸和稀氢氧化钠中和热的实验装置如图所示.(1)从实验装置上看,图中尚缺少的一种玻璃用品是环形玻璃搅拌棒.
(2)烧杯间填满碎纸条的作用是减少实验过程中的热量损失.
(3)取50mL NaOH溶液和30mL硫酸溶液进行实验,实验数据如下表.
①请填写下表中的空白:
| 温度 实验次数 | 起始温度t1/℃ | 终止温度 t2/℃ | 温度差平均值 (t2-t1)/℃ | ||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 30.1 | 4.0 |
| 2 | 27.0 | 27.4 | 27.2 | 33.3 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.8 | |
| 4 | 26.4 | 26.2 | 26.3 | 30.4 | |
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度.
| A. | c(A)增大时,v增大,k也增大 | B. | c(B)增大时,v增大,k值不变 | ||
| C. | 升高温度时,v增大,k值不变 | D. | 升高温度时,v值不变,k增大 |