题目内容
5.某体积可变的密闭容器中盛有适量的A和B的混合气体,在一定条件下发生反应:A(g)+3B(g)?2C(g),若维持温度和压强不变,当达到平衡时,容器的体积为V L,其中气体C的体积为0.1V L.下列推断中正确的是( )| A. | 原混合气体的体积为1.2V L | B. | 原混合气体的体积为1.1V L | ||
| C. | 反应达平衡时气体A消耗掉0.05V L | D. | 反应达平衡时气体B消耗掉0.05V L |
分析 平衡时生成C的体积为0.1VL,根据方程式计算消耗A、B的体积、气体体积减少量,原混合气体体积=平衡时体积+减小的体积.
解答 解:平衡时生成C的体积为0.1VL,则:
A(g)+3 B(g)?2 C(g) 体积减小△V
1 3 2 2
0.05VL 0.15VL 0.1VL 0.1VL
则原混合气体总体积=VL+0.1VL=1.1V L
反应达平衡时气体A消耗掉0.05V L,气体B消耗掉0.15V L,
故选:BC.
点评 本题考查化学平衡计算,比较基础,注意利用差量法进行解答,侧重考查学生分析和解决问题的能力.

练习册系列答案
 寒假大串联黄山书社系列答案
寒假大串联黄山书社系列答案 寒假创新型自主学习第三学期寒假衔接系列答案
寒假创新型自主学习第三学期寒假衔接系列答案
相关题目
9.2009年4月16日CCTV《科技博览》报道,中国科学院首创用CO2合成可降解塑料聚二氧化碳.下列相关说法不合理的是( )
| A. | 二氧化碳塑料是通过加聚反应制得的 | |
| B. | 用上业废弃物二氧化碳生产塑料,有助于缓解温室效应 | |
| C. | 二氧化碳塑料不能在空气中燃烧 | |
| D. | 聚二氧化碳塑料的使用会产生白色污染 |
10.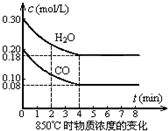 在密闭容器中,将起始浓度均为2mol/L的CO和H2O混合加热到400℃,发生下列反应:CO(g)+H2O(g)?CO2(g)+H2(g),一段时间后该反应达到平衡,测得CO的浓度为0.5mol/L,则:
在密闭容器中,将起始浓度均为2mol/L的CO和H2O混合加热到400℃,发生下列反应:CO(g)+H2O(g)?CO2(g)+H2(g),一段时间后该反应达到平衡,测得CO的浓度为0.5mol/L,则:
(1)平衡时CO的转化率为75%;该反应在该温度时的化学平衡常数为9.
(2)在相同的条件下,如果H2O和CO的起始浓度变为4mol/L,则CO的转化率为75%.
(3)800℃时,该反应的平衡常数为1,则该反应的△H< 0(填>,<,=)
(4)改变起始条件,在一体积为10L的容器中,通入一定量的CO和H2O,在850℃时发生上述反应,CO和H2O浓度变化如图,则0~4min的平均反应速率v(CO)=0.03mol/(L•min)
(5)t℃(高于850℃)时,在相同容器中发生上述反应,容器内各物质的浓度变化如表:
t℃时物质浓度(mol/L)的变化
①表中3min~4min之间反应处于平衡状态; C1数值大于0.08mol/L(填大于、小于或等于).
②反应在4min~5min问,平衡向逆方向移动,可能的原因是D(单选),
表中5min~6min之间数值发生变化,可能的原因是A(单选).
A.增加水蒸气 B.降低温度 C.使用催化剂 D.增加氢气浓度.
 在密闭容器中,将起始浓度均为2mol/L的CO和H2O混合加热到400℃,发生下列反应:CO(g)+H2O(g)?CO2(g)+H2(g),一段时间后该反应达到平衡,测得CO的浓度为0.5mol/L,则:
在密闭容器中,将起始浓度均为2mol/L的CO和H2O混合加热到400℃,发生下列反应:CO(g)+H2O(g)?CO2(g)+H2(g),一段时间后该反应达到平衡,测得CO的浓度为0.5mol/L,则:(1)平衡时CO的转化率为75%;该反应在该温度时的化学平衡常数为9.
(2)在相同的条件下,如果H2O和CO的起始浓度变为4mol/L,则CO的转化率为75%.
(3)800℃时,该反应的平衡常数为1,则该反应的△H< 0(填>,<,=)
(4)改变起始条件,在一体积为10L的容器中,通入一定量的CO和H2O,在850℃时发生上述反应,CO和H2O浓度变化如图,则0~4min的平均反应速率v(CO)=0.03mol/(L•min)
(5)t℃(高于850℃)时,在相同容器中发生上述反应,容器内各物质的浓度变化如表:
t℃时物质浓度(mol/L)的变化
| 时间(min) | CO | H2O | CO2 | H2 |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | C1 | C2 | C3 | C3 |
| 4 | C1 | C2 | C3 | C3 |
| 5 | 0.116 | 0.216 | 0.084 | 0.104 |
| 6 | 0.096 | 0.266 | 0.104 |
②反应在4min~5min问,平衡向逆方向移动,可能的原因是D(单选),
表中5min~6min之间数值发生变化,可能的原因是A(单选).
A.增加水蒸气 B.降低温度 C.使用催化剂 D.增加氢气浓度.
14.下表是元素周期表的一部分,其中a、b、c、d、e、f各代表一种元素,请回答下列问题:
(1)最简单的有机物是由b元素和a(填字母)元素组成的;
(2)e的元素符号是Na;
(3)b、c、d、三种元素的非金属性逐渐增强(填减弱或增强);
(4)a元素和f元素形成化合物的电子式为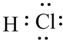 .
.
| 族 周期 | IA | 0 | ||||||
| 1 | a | ⅡA | ⅢA | ⅣA | VA | ⅥA | VⅡA | |
| 2 | b | c | d | |||||
| 3 | e | f | ||||||
(2)e的元素符号是Na;
(3)b、c、d、三种元素的非金属性逐渐增强(填减弱或增强);
(4)a元素和f元素形成化合物的电子式为
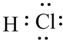 .
.
15.今有一种标况下为固态的化合物X,X本身不导电,其熔化状态或水溶液能够导电,下列关于该化合物X的说法中,正确的是( )
| A. | X是电解质的可能性大 | B. | X不可能是非电解质 | ||
| C. | X只能是盐类 | D. | X可以是任意化合物 |


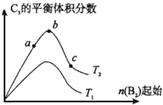 已知2A2(g)+B2(g)?2C3(g);△H=-Q1kJ/mol(Q1>0),在一个有催化剂的固定容积的容器中加入2molA2和1molB2,在500℃时充分反应,达平衡后C3的浓度为w mol•L-1,放出热量为Q2kJ.
已知2A2(g)+B2(g)?2C3(g);△H=-Q1kJ/mol(Q1>0),在一个有催化剂的固定容积的容器中加入2molA2和1molB2,在500℃时充分反应,达平衡后C3的浓度为w mol•L-1,放出热量为Q2kJ.