题目内容
【题目】有一处于平衡状态的可逆反应:X(s)+3Y(g)![]() 2Z(g) ΔH<0。为了使平衡向生成Z的方向移动,应选择的条件是
2Z(g) ΔH<0。为了使平衡向生成Z的方向移动,应选择的条件是
①高温 ②低温 ③高压 ④低压 ⑤加催化剂 ⑥分离出Z
A.①③⑤B.②③⑤C.②③⑥D.②④⑥
【答案】C
【解析】
①升高温度,平衡向吸热反应移动;
②降低温度,平衡向放热反应移动;
③压强增大,平衡向气体体积减小的方向移动;
④降低压强,平衡向气体体积增大的方向移动;
⑤加催化剂不会引起化学平衡的移动;
⑥分离出Z,即减小生成物的浓度,平衡正向移动。
反应X(s)+3Y(g)![]() 2Z(g),△H<0,正反应是气体物质的量减小的放热反应。
2Z(g),△H<0,正反应是气体物质的量减小的放热反应。
①升高温度,平衡逆向移动,故①错误;
②降低温度,平衡向正反应移动,故②正确;
③压强增大,平衡向正反应移动,故③正确;
④降低压强,平衡向逆反应方向移动,故④错误;
⑤加催化剂缩短到达平衡的时间,不会引起化学平衡的移动,故⑤错误;
⑥分离出Z,即减小生成物的浓度,平衡正向移动,故⑥正确;
故选C。

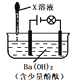
【题目】滴有酚酞的Ba(OH)2溶液显红色,在上述溶液中分别滴加X溶液后有下列现象。下列说法不正确的是
序号 | 装置 | X溶液 | 现象 |
I |
| 盐酸 | 溶液红色褪去,无沉淀,灯泡亮度没有明显变化 |
II | Na2SO4 | 溶液红色不变,有白色沉淀生成,灯泡亮度没有明显变化 | |
III | H2SO4 | 溶液红色褪去,有白色沉淀生成,灯泡逐渐变暗 |
A. 实验I中溶液红色褪去,说明发生了反应H+ + OH- =H2O
B. 实验II中溶液红色不变,且灯泡亮度没有明显变化,说明溶液中依然存在有大量的Na+与OH-
C. 实验III中溶液红色褪去,有白色沉淀生成,灯泡逐渐变暗,说明发生了反应Ba2+ + 2OH- + 2H+ + SO42- == BaSO4↓+ 2H2O
D. 将实验II中Na2SO4溶液换成CuSO4溶液,现象与原实验II中的现象相同