题目内容
1.向装有乙醇的烧杯中投入一小块金属钠,下列对实验现象的描述中正确的是( )| A. | 钠熔化成小球 | |
| B. | 钠块沉在乙醇液面的下面 | |
| C. | 钠块在乙醇的液面上游动 | |
| D. | 钠块表面有气泡放出,有轻微爆炸产生 |
分析 与水相比较,乙醇密度较小,钠与乙醇反应时,钠沉在乙醇液面的下面,钠与乙醇反应不如钠与水反应剧烈,可生成乙醇钠和氢气,据此分析解答.
解答 解:A.虽然Na与乙醇反应也放热,但Na的熔点比乙醇的沸点高,Na在乙醇中反应不会熔化成小球,故A错误;
B.由于乙醇的密度比钠小,钠块沉在乙醇液面下,故B正确;
C.由于乙醇的密度比钠小,钠块沉在乙醇液面下,不会观察到钠块在乙醇的液面上游动的现象,故C错误;
D.钠在乙醇中反应不剧烈所以没有轻微爆炸产生,只是缓缓产生气泡,故D错误;
故选B.
点评 本题考查钠和乙醇的反应,侧重考查学生分析判断能力,以乙醇、水分别和Na反应现象进行对比,由此判断水、乙醇中-OH电离出氢离子难易程度,题目难度不大.

练习册系列答案
相关题目
11.下列实验操作使测定(或配制)结果偏高的是( )
| A. | 配制一定物质的量浓度的溶液,定容时俯视刻度线 | |
| B. | 测量一包固体的质量,将药品放在右盘,砝码放在左盘,并需移动游码使之平衡 | |
| C. | 中和滴定用的锥形瓶加入待测液后,再加少量蒸馏水稀释 | |
| D. | 在敞口容器中测量氢氧化钠和稀盐酸反应的中和热 |
12.科学家在研究探索中不断发现新的物质,据报道,1996年科学家在宇宙中发现了H3分子,那么H3和H2属于( )
| A. | 同位素 | B. | 同分异构体 | C. | 同系物 | D. | 同素异形体 |
9.在一定温度下的定容密闭容器中,当物质的下列物理量不再变化时,表明反应:A(s)+2B(g)?C(g)+D(g)已达平衡的是( )
| A. | 混合气体的压强 | B. | 混合气体的密度 | ||
| C. | B物质的相对分子质量 | D. | 气体的总物质的量 |
16.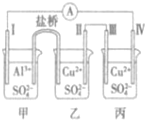 某电化学装置如图所示,电极I为Al,其它均为Cu,且开始时四电极质量均相等,下列叙述正确的是( )
某电化学装置如图所示,电极I为Al,其它均为Cu,且开始时四电极质量均相等,下列叙述正确的是( )
 某电化学装置如图所示,电极I为Al,其它均为Cu,且开始时四电极质量均相等,下列叙述正确的是( )
某电化学装置如图所示,电极I为Al,其它均为Cu,且开始时四电极质量均相等,下列叙述正确的是( )| A. | 甲为原电池,乙、丙均为电解池 | |
| B. | 电子流动方向:电极Ⅳ→A→电极I | |
| C. | 当0.1mol电子转移时,电极I和电极Ⅳ的质量差为4.1g | |
| D. | 若丙中的电解质改为CuCl2,电极Ⅲ的电极反应发生改变 |
6.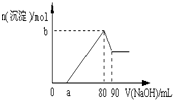 把一块镁铝合金投入到1mol/L酸中,待合金完全溶解后,再往溶液里加入1mol/L NaOH溶液,生成沉淀的物质的量随加入NaOH溶液的体积变化的关系如图所示,下列说法中错误的是( )
把一块镁铝合金投入到1mol/L酸中,待合金完全溶解后,再往溶液里加入1mol/L NaOH溶液,生成沉淀的物质的量随加入NaOH溶液的体积变化的关系如图所示,下列说法中错误的是( )
 把一块镁铝合金投入到1mol/L酸中,待合金完全溶解后,再往溶液里加入1mol/L NaOH溶液,生成沉淀的物质的量随加入NaOH溶液的体积变化的关系如图所示,下列说法中错误的是( )
把一块镁铝合金投入到1mol/L酸中,待合金完全溶解后,再往溶液里加入1mol/L NaOH溶液,生成沉淀的物质的量随加入NaOH溶液的体积变化的关系如图所示,下列说法中错误的是( )| A. | 盐酸的体积为80ml | B. | a的取值范围为0≤a<50 | ||
| C. | n(Mg2+)<0.025mol | D. | 当a值为30时,b值为0.01 |
13.将KClO3、I2各0.02mol加入12 克36.5%的盐酸中,I2恰好完全溶解,没有气体产生(不考虑盐酸的挥发).将反应后的溶液用冰水冷却,析出橙红色晶体A(A在常温下就有升华现象),过滤,将滤液蒸干,收集到KCl固体、8.7g液态水和极少量的A蒸气.则A的化学式可能是( )
| A. | I2Cl6 | B. | ICl5 | C. | HClO | D. | KIO3 |
10.25℃时在五份蒸馏水中分别加入适量的下列物质,所得实验结果如表所示:加入物质后水的电离程度由大到小排列顺序正确的是( )
| 加入物质 | HCl(aq) | FeCl3 | NaOH | HCOONa | C2H5OH |
| 溶液的pH | 3 | 4 | 10 | 11 | 未确定 |
| 水的电离程度 | α1 | α2 | α3 | α4 | α5 |
| A. | α3>α1>α5>α2>α4 | B. | α4>α2>α5>α1>α3 | C. | α4>α2>α5>α3>α1 | D. | α1>α3>α5>α2>α4 |
5. 苯甲酸广泛用于医药、食品、染料、化工等领域.以下是实验室制备苯甲酸的一种方法.反应原理:
苯甲酸广泛用于医药、食品、染料、化工等领域.以下是实验室制备苯甲酸的一种方法.反应原理:
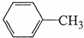 +2KMnO4$\stackrel{△}{→}$
+2KMnO4$\stackrel{△}{→}$ +2MnO2↓+KOH+H2O
+2MnO2↓+KOH+H2O
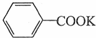 +HCl→
+HCl→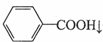 +KCl
+KCl
实验步骤:
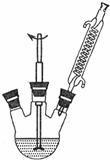
①按图组装反应装置(冷凝水、夹持及加热装置未画出),并在三颈烧瓶中依次加入120mL水、9.4g高锰酸钾和3.0mL甲苯.
②将三颈烧瓶中的混合液体搅拌、加热至沸腾,直到甲苯完全反应.
③趁热过滤反应混合物.若滤液呈紫色,则需加入适量的亚硫酸氢钠溶液至紫色褪去后再过滤,用热水洗涤滤渣,洗涤液合并至滤液中.
④用冰水冷却滤液,然后用浓盐酸酸化,过滤,用少量冷水洗涤滤渣,得到苯甲酸粗产品,经重结晶得到精制的苯甲酸.
回答下列问题:
(1)三颈烧瓶所盛液体体积通常占其容积的1/3~2/3,则本实验应选择的三颈烧瓶规格为B(填字母序号).A.100mL B.250mL C.500mL D.1000mL
(2)判断甲苯己完全反应的现象是三颈烧瓶内溶液不分层、回流液不再出现油珠.
(3)实验步骤④中,用少量冷水而不用热水洗涤滤渣的目的是减少苯甲酸因溶解造成的损失;苯甲酸粗产品除了可用重结晶法精制外,还可用升华法.
(4)写出碱性高锰酸钾溶液与亚硫酸氢钠反应生成黑色沉淀的离子方程式2MnO4-+3HSO3-+OH-=2MnO2↓+3SO42-+2 H2O
(5)精制的苯甲酸纯度测定:称取1.220g样品,用稀乙醇溶解并配成100mL溶液,分别取25.00mL溶液,用0.1000mo1•L-1NaOH标准溶液滴定,三次滴定消耗NaOH溶液的体积分别为V1=24.70mL.V2=24.80mL.V3=25.80mL.
①配制溶液时用稀乙醇而不用蒸馏水作溶剂的原因是常温下苯甲酸微溶于水而易溶于乙醇.
②若用酚酞作指示剂,确定滴定终点的现象是加入最后一滴NaOH溶液,溶液由无色变为浅红色.
③产品的纯度为99.00%.
 苯甲酸广泛用于医药、食品、染料、化工等领域.以下是实验室制备苯甲酸的一种方法.反应原理:
苯甲酸广泛用于医药、食品、染料、化工等领域.以下是实验室制备苯甲酸的一种方法.反应原理: +2KMnO4$\stackrel{△}{→}$
+2KMnO4$\stackrel{△}{→}$ +2MnO2↓+KOH+H2O
+2MnO2↓+KOH+H2O +HCl→
+HCl→ +KCl
+KCl| 名称 | 相对分子质量 | 性状 | 熔点/℃ | 溶解度 | |
| 不溶 | 乙醇 | ||||
| 甲苯 | 92 | 无色液体易燃易挥发 | -95 | 不溶 | 易溶 |
| 苯甲酸 | 122 | 白色片状或针状晶体 | 122.4(100℃升华) | 25℃0.35g 80℃,2.7g | 易溶 |
①按图组装反应装置(冷凝水、夹持及加热装置未画出),并在三颈烧瓶中依次加入120mL水、9.4g高锰酸钾和3.0mL甲苯.
②将三颈烧瓶中的混合液体搅拌、加热至沸腾,直到甲苯完全反应.
③趁热过滤反应混合物.若滤液呈紫色,则需加入适量的亚硫酸氢钠溶液至紫色褪去后再过滤,用热水洗涤滤渣,洗涤液合并至滤液中.
④用冰水冷却滤液,然后用浓盐酸酸化,过滤,用少量冷水洗涤滤渣,得到苯甲酸粗产品,经重结晶得到精制的苯甲酸.
回答下列问题:
(1)三颈烧瓶所盛液体体积通常占其容积的1/3~2/3,则本实验应选择的三颈烧瓶规格为B(填字母序号).A.100mL B.250mL C.500mL D.1000mL
(2)判断甲苯己完全反应的现象是三颈烧瓶内溶液不分层、回流液不再出现油珠.
(3)实验步骤④中,用少量冷水而不用热水洗涤滤渣的目的是减少苯甲酸因溶解造成的损失;苯甲酸粗产品除了可用重结晶法精制外,还可用升华法.
(4)写出碱性高锰酸钾溶液与亚硫酸氢钠反应生成黑色沉淀的离子方程式2MnO4-+3HSO3-+OH-=2MnO2↓+3SO42-+2 H2O
(5)精制的苯甲酸纯度测定:称取1.220g样品,用稀乙醇溶解并配成100mL溶液,分别取25.00mL溶液,用0.1000mo1•L-1NaOH标准溶液滴定,三次滴定消耗NaOH溶液的体积分别为V1=24.70mL.V2=24.80mL.V3=25.80mL.
①配制溶液时用稀乙醇而不用蒸馏水作溶剂的原因是常温下苯甲酸微溶于水而易溶于乙醇.
②若用酚酞作指示剂,确定滴定终点的现象是加入最后一滴NaOH溶液,溶液由无色变为浅红色.
③产品的纯度为99.00%.