题目内容
13.工业上合成氨的化学反应:N2(g)+3H2(g)?2NH3(g)△H=-46.2KJ•mol-1、△S=-198.3J•mol-1•K-1,且△G=△H-T△S.在容积为10L的密闭容器中,通入40mol N2和120mol H2在一定条件下进行反应,4S后达到平衡状态,此时N2的浓度为2mol/L.通过计算回答下列问题:(1)在温度为500K时,该反应能(填“能”或“不能”)自发进行.反应进行到平衡状态时△G=0.
(2)用N2 表示的4S内化学反应的平均速率是0.05mol/(L•s).
(3)在该条件下N2 的最大转化率是50%;此时混合气体中NH3的体积分数是25%.
(4)为了提高氨气的产率,可以选择的方法是②④ (填序号,错选扣分).
①升高温度 ②增大压强 ③使用催化剂 ④及时分离出NH3.
分析 (1)△G=△H-T△S<0时,反应能够自发进行,据此分析;
(2)根据n=cV计算出达到平衡时氮气的物质的量,据v=$\frac{△c}{△t}$求反应速率;
(3)分别计算出氮气的转化率、混合气体中氨气的体积分数;
(4)根据温度、压强对化学平衡的影响进行解答.
解答 解:(1)△G=△H-T△S=-92.4×1000J/mol-[-98.3J/(mol•K)]×500K=-43250kJ/mol<0,所以该反应能够自发进行;△H-T△S=0时反应达到平衡状态,
故答案为:能;0;
(2)达到平衡时N2的浓度为0.2mol/L,平衡时氮气的物质的量为:n(N2)=0.2mol/L×10L=2mol,达到平衡时消耗氮气的物质的量为:4mol-2mol=2mol,
N2(g)+3H2(g)═2NH3(g)△n
1 3 2 2
起始量(物质的量) 4 12 0
转化量(物质的量) 2 6 4 4
平衡量(物质的量) 2 6 4 4
v(N2)=$\frac{\frac{2mol}{10L}}{4s}$=0.05mol/(L•s),故答案为:0.05mol/(L•s);
(3)n(NH3)=4mol,该条件下N2的最大转化率为:$\frac{2mol}{4mol}$×100%=50%;
此时混合气体中NH3的体积分数是:$\frac{4mol}{2mol+6mol-4mol}$×100%=25%;
故答案为:50%;25%;
(4)要提高氨的产率,需要使平衡向着正向移动,该反应为放热、气体体积减小的可逆反应,则低温、高压条件下有利于平衡向着正向移动,及时分离出氨气,有利于提高氨气的产率,
故答案为:②④.
点评 本题考查了化学反应速率、化学平衡的影响因素、化学平衡的计算等知识,题目难度中等,注意掌握影响化学反应速率、化学平衡的因素,试题充分考查了学生的分析、理解能力及灵活应用所学知识的能力.

| A. | 与Al反应放出氢气的溶液中:Na+、H+、NH4+、NO3- | |
| B. | 在c(H+)=1.0×10-13,mol/L的溶液中:Na+、K+、AlO2-、CO32- | |
| C. | 澄清透明的溶液中:Fe3+、Mg2+、NO3-、S2- | |
| D. | 在pH=1的溶液中:NH4+、K+、ClO-、Cl- |
| A. | 溶液是呈电中性的,而胶体是可以带电的 | |
| B. | 向沸水中加入FeCl3饱和溶液,继续煮沸至溶液呈红褐色时即得到Fe(OH)3胶体 | |
| C. | 清晨,阳光透过树叶间的缝隙可以产生丁达尔效应,说明空气是一种胶体 | |
| D. | 常用于区分溶液和胶体的方法是利用丁达尔效应,属于化学方法 |
| A. | 分液漏斗 | B. | 普通漏斗 | C. | 蒸馏烧瓶 | D. | 试管 |
①氢氧化钠 ②硫酸钡 ③铜 ④蔗糖 ⑤二氧化硫.
| A. | ①② | B. | ①②⑤ | C. | ③④ | D. | ①⑤ |
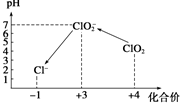 ClO2气体是一种在水处理等方面有广泛应用的高效安全消毒剂.我国从2 000年起逐步用ClO2代替氯气对饮用水进行消毒.
ClO2气体是一种在水处理等方面有广泛应用的高效安全消毒剂.我国从2 000年起逐步用ClO2代替氯气对饮用水进行消毒.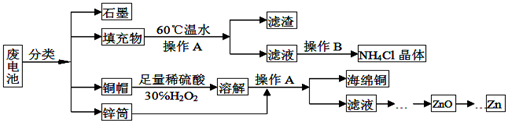
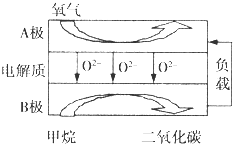 甲烷是天然气的主要成分,是生产生活中应用非常广泛的一种化学物质.
甲烷是天然气的主要成分,是生产生活中应用非常广泛的一种化学物质.