题目内容
100℃时,在1L恒温恒容的密闭容器中,通入0.1mol N2O4,发生反应:N2O4(g)?2NO2(g);△H=+57.0kJ?mol-1,NO2和N2O4的浓度如图甲所示.NO2和N2O4的消耗速率与其浓度的关系如乙图所示,
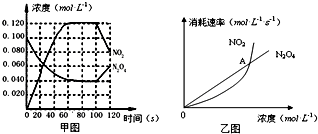
(1)在0~60s内,以N2O4表示的平均反应速率为 mol?L-1?s-1.
(2)根据甲图中有关数据,计算100℃时该反应的平衡常数:K1═ ═0.36mol?L-1?S-1
若其他条件不变,升高温度至120℃,达到新平衡的常数是k2,则k1 k2(填“>”、“<”或“=”).
(3)反应进行到100s时,若有一项条件发生变化,变化的条件可能是 .
A.降低温度 B.通入氦气使其压强增大
C.又往容器中充入N2O4 D.增加容器体积
(4)乙图中,交点A表示该反应的所处的状态为 .
A.平衡状态 B.朝正反应方向移动
C.朝逆反应方向移动 D.无法判断
(5)已知:
N2(g)+2O2(g)═2NO2(g);△H=+67.2kJ?mol-1.
N2H4(g)+O2(g)═N2(g)+2H2O(g)△H=-534.7kJ?mol-1.
N2O4(g)?2NO2(g)△H=+57.0kJ?mol-1.
则:2N2H4(g)+N2O4(g)═3N2(g)+4H2O(g)△H= kJ?mol-1.

(1)在0~60s内,以N2O4表示的平均反应速率为
(2)根据甲图中有关数据,计算100℃时该反应的平衡常数:K1═
若其他条件不变,升高温度至120℃,达到新平衡的常数是k2,则k1
(3)反应进行到100s时,若有一项条件发生变化,变化的条件可能是
A.降低温度 B.通入氦气使其压强增大
C.又往容器中充入N2O4 D.增加容器体积
(4)乙图中,交点A表示该反应的所处的状态为
A.平衡状态 B.朝正反应方向移动
C.朝逆反应方向移动 D.无法判断
(5)已知:
N2(g)+2O2(g)═2NO2(g);△H=+67.2kJ?mol-1.
N2H4(g)+O2(g)═N2(g)+2H2O(g)△H=-534.7kJ?mol-1.
N2O4(g)?2NO2(g)△H=+57.0kJ?mol-1.
则:2N2H4(g)+N2O4(g)═3N2(g)+4H2O(g)△H=
考点:物质的量或浓度随时间的变化曲线,用盖斯定律进行有关反应热的计算,化学平衡的影响因素,化学平衡状态的判断
专题:化学平衡专题
分析:由图甲可知知,起始时c( N2O4)=0.1mol/L,60秒时反应处于平衡状态时c′( N2O4)=0.04mol/L,c′( NO2)=0.12mol/L,
(1)根据
计算反应速率;
(2)根据平衡常数的定义写表达式,根据影响平衡移动的因素作判断;
(3)根据图象可知,100s时N2O4浓度在原来的基础上变大,而NO2的浓度在原来的基础上变小,说明平衡向逆反应方向移动,是通过温度的变化而影响的,而这个反应为吸热反应,所以改变的条件为降温,据此答题;
(4)乙图中,交点A表示消耗的速率v( N2O4)=v( NO2),该反应的所处的状态时,消耗的速率2v( N2O4)=v( NO2),所以此时,二氧化氮的消耗速率小于四氧化二氮的消耗速率,反应向正反应方向移动,据此判断;
(5)根据盖斯定律计算出反应热,写出热化学方程式;
(1)根据
| △c |
| △t |
(2)根据平衡常数的定义写表达式,根据影响平衡移动的因素作判断;
(3)根据图象可知,100s时N2O4浓度在原来的基础上变大,而NO2的浓度在原来的基础上变小,说明平衡向逆反应方向移动,是通过温度的变化而影响的,而这个反应为吸热反应,所以改变的条件为降温,据此答题;
(4)乙图中,交点A表示消耗的速率v( N2O4)=v( NO2),该反应的所处的状态时,消耗的速率2v( N2O4)=v( NO2),所以此时,二氧化氮的消耗速率小于四氧化二氮的消耗速率,反应向正反应方向移动,据此判断;
(5)根据盖斯定律计算出反应热,写出热化学方程式;
解答:
解:由图甲可知知,起始时c( N2O4)=0.1mol/L,60秒时反应处于平衡状态时c′( N2O4)=0.04mol/L,c′( NO2)=0.12mol/L,
(1)根据
,以N2O4表示的平均反应速率为
=1×10-3mol/(L?s),故答案为为:1×10-3;
(2)根据平衡常数的定义写表达式K=
,因为该反应为吸热反应,根据温度对平衡移动的影响可知,升温平衡向吸热反应方向移动即正向移动,所以K值变大,k1<k2,
故答案为:
,<;
(3)根据图象可知,100s时N2O4浓度在原来的基础上变大,而NO2的浓度在原来的基础上变小,说明平衡向逆反应方向移动,是通过温度的变化而影响的,而这个反应为吸热反应,所以改变的条件为降温,故选A;
(4)乙图中,交点A表示的消耗速率v( N2O4)=v( NO2),而达到平衡时NO2的消耗速率应该是N2O4消耗速率的2倍,v( NO2)=2v( N2O4),因此此时v逆<v正,所以反应向正反应方向移动,故选B;
(5)①N2(g)+2O2(g)═2NO2(g);△H=+67.2kJ?mol-1.
②N2H4(g)+O2(g)═N2(g)+2H2O(g)△H=-534.7kJ?mol-1.
③N2O4(g) ?2NO2(g)△H=+57.0kJ?mol-1.
?2NO2(g)△H=+57.0kJ?mol-1.
根据盖斯定律,②×2-①+③可写出热化学方程式2N2H4(g)+N2O4(g)═3N2(g)+4H2O(g)△H=-534.7kJ?mol-1×2-67.2kJ?mol-1+57.0kJ?mol-1=-1079.6kJ?mol-1;故答案为:-1079.6.
(1)根据
| △c |
| △t |
| 0.1mol/L-0.04mol/L |
| 60s |
(2)根据平衡常数的定义写表达式K=
| c2(NO2) |
| c (N2O4) |
故答案为:
| c2(NO2) |
| c (N2O4) |
(3)根据图象可知,100s时N2O4浓度在原来的基础上变大,而NO2的浓度在原来的基础上变小,说明平衡向逆反应方向移动,是通过温度的变化而影响的,而这个反应为吸热反应,所以改变的条件为降温,故选A;
(4)乙图中,交点A表示的消耗速率v( N2O4)=v( NO2),而达到平衡时NO2的消耗速率应该是N2O4消耗速率的2倍,v( NO2)=2v( N2O4),因此此时v逆<v正,所以反应向正反应方向移动,故选B;
(5)①N2(g)+2O2(g)═2NO2(g);△H=+67.2kJ?mol-1.
②N2H4(g)+O2(g)═N2(g)+2H2O(g)△H=-534.7kJ?mol-1.
③N2O4(g)
 ?2NO2(g)△H=+57.0kJ?mol-1.
?2NO2(g)△H=+57.0kJ?mol-1.根据盖斯定律,②×2-①+③可写出热化学方程式2N2H4(g)+N2O4(g)═3N2(g)+4H2O(g)△H=-534.7kJ?mol-1×2-67.2kJ?mol-1+57.0kJ?mol-1=-1079.6kJ?mol-1;故答案为:-1079.6.
点评:本题主要考查了化学反应速率、化学平衡常数的计算、影响化学平衡移动的因素、热化学方程式等知识点,有一定的综合性,难度中等.

练习册系列答案
相关题目
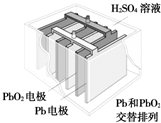 汽车的启动电源常用铅蓄电池.其结构如图所示,放电时的电池反应如下:PbO2+Pb+2H2SO4═2PbSO4+2H2O根据此反应判断下列叙述中正确的是( )
汽车的启动电源常用铅蓄电池.其结构如图所示,放电时的电池反应如下:PbO2+Pb+2H2SO4═2PbSO4+2H2O根据此反应判断下列叙述中正确的是( )| A、PbO2是电池的负极 |
| B、Pb是负极 |
| C、PbO2得电子,被氧化 |
| D、电池放电时,溶液酸性减弱 |
某单质X能从盐的溶液中置换出单质Y,由此推断出下列说法正确的是( )
| A、X、Y都是金属时,则X一定比Y活泼 |
| B、X一定排在金属活动顺序表中H的前面 |
| C、X是金属时,Y可能是金属也可能是非金属 |
| D、X是非金属时,Y可能是金属也可能是非金属 |
下列有机物命名正确的是( )
A、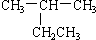 2-乙基丙烷 2-乙基丙烷 |
B、 1,2-二溴乙烷 1,2-二溴乙烷 |
C、 间二甲苯 间二甲苯 |
D、 2-甲基-2-丙烯 2-甲基-2-丙烯 |
下列说法正确的是( )
| A、常温下,将pH=5的醋酸溶液稀释到原体积的1000倍后,溶液的pH=8 |
| B、为确定某酸H2A是强酸还是弱酸,可测NaHA溶液的pH.若pH>7,则H2A是弱酸;若pH<7,则H2A是强酸 |
| C、由0.1mol?L-1一元碱BOH溶液的pH=10,推知BOH溶液存在BOH?B++OH- |
| D、用0.2000mol?L-1 NaOH标准溶液滴定HCl与CH3COOH的混合液(混合液中两种酸的浓度均约为0.1mol?L-1),至中性时,溶液中的酸恰好被完全中和 |
 某些废旧塑料可采用下列方法处理:将废塑料隔绝空气加强热,使其变成有用的物物质,其实验装置如图.加热聚丙烯废塑料得到的产物如下表:
某些废旧塑料可采用下列方法处理:将废塑料隔绝空气加强热,使其变成有用的物物质,其实验装置如图.加热聚丙烯废塑料得到的产物如下表: