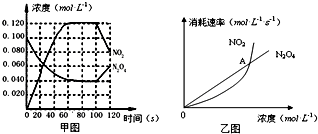
题目内容
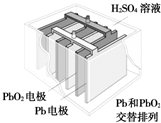 汽车的启动电源常用铅蓄电池.其结构如图所示,放电时的电池反应如下:PbO2+Pb+2H2SO4═2PbSO4+2H2O根据此反应判断下列叙述中正确的是( )
汽车的启动电源常用铅蓄电池.其结构如图所示,放电时的电池反应如下:PbO2+Pb+2H2SO4═2PbSO4+2H2O根据此反应判断下列叙述中正确的是( )| A、PbO2是电池的负极 |
| B、Pb是负极 |
| C、PbO2得电子,被氧化 |
| D、电池放电时,溶液酸性减弱 |
考点:常见化学电源的种类及其工作原理
专题:电化学专题
分析:根据放电时的电池反应PbO2+Pb+2H2SO4═2PbSO4+2H2O可知,Pb在反应中失去电子,为电池的负极,PbO2在放电过程中得到电子被还原,所以它是原电池的正极;原电池放电的过程中消耗硫酸,所以溶液的酸性减弱,据此进行解答.
解答:
解:A.原电池中负极失去电子发生氧化反应,根据电池放电时的反应:PbO2+Pb+2H2SO4═2PbSO4+2H2O可知,负极Pb失去电子,即Pb为负极,PbO2为正极,故A错误;
B.根据电池反应可知,Pb在反应中失去电子生成PbSO4,所以Pb为电池的负极,故B正确;
C.PbO2在放电过程中化合价降低,得到电子被还原,所以PbO2为原电池的正极、反应中被还原,故C错误;
D.由于原电池放电的过程中消耗硫酸,电解质溶液中氢离子浓度逐渐减小,所以溶液的酸性减弱,故D正确;
故选BD.
B.根据电池反应可知,Pb在反应中失去电子生成PbSO4,所以Pb为电池的负极,故B正确;
C.PbO2在放电过程中化合价降低,得到电子被还原,所以PbO2为原电池的正极、反应中被还原,故C错误;
D.由于原电池放电的过程中消耗硫酸,电解质溶液中氢离子浓度逐渐减小,所以溶液的酸性减弱,故D正确;
故选BD.
点评:本题考查了常见的化学电源及工作原理,题目难度中等,注意掌握常见化学电源的类型及工作原理,能够根据原电池总反应判断两极,并能够正确书写电极反应式.

练习册系列答案
相关题目
下列各组离子一定能大量共存的是( )
A、
| ||
| B、使pH试纸显红色的溶液:K+、I-、Cl-、NO3- | ||
| C、由水电离的c(H+)=1×10-14mol?L-1的溶液:Na+、K+、AlO2-、Cl- | ||
| D、澄清透明的无色溶液:Na+、Cu2+、Cr2O72-、NO3- |
下列分散系均能发生丁达尔现象的选项( )
| A、酒.生理盐水.花生油 |
| B、雾.含灰尘颗粒的空气.有色玻璃 |
| C、水晶.金刚石.冰 |
| D、大理石.高岭石.电石 |
在约100℃的温度下,NaCl稀溶液中[H+]为1×10-6 mol?L-1.下列说法中正确的是( )
| A、该NaCl溶液显酸性 |
| B、该NaCl溶液显碱性 |
| C、该NaCl溶液中KW=1×10-14mol2?L-2 |
| D、该NaCl溶液中KW=1×10-12mol2?L-2 |
下列物质①过滤后的天然水 ②变浑浊的石灰水 ③石蕊试液 ④牛奶 ⑤盐酸 ⑥碘酒,其中属于溶液的是( )
| A、①③ | B、②④ |
| C、③⑤⑥ | D、①③⑤⑥ |
向游泳池里投放漂白精或液氯都可以起到杀菌、消毒的作用,其原理是( )
| A、依靠氯气分子本身的较强氧化性杀菌 |
| B、生成盐酸,使病菌无法存活 |
| C、依靠氯原子的还原性起杀菌消毒的作用 |
| D、依靠次氯酸的强氧化性起杀菌消毒的作用 |
(双项)美国《科学》杂志曾报道:在40G Pa高压下,用激光器加热到1800K,人们成功制得了原子晶体干冰,下列推断正确的是( )
| A、原子晶体干冰有很高的熔点、沸点,有很大的硬度 |
| B、原子晶体干冰易汽化,可用作制冷材料 |
| C、原子晶体干冰硬度大,可用作耐磨材料 |
| D、每摩尔原子晶体干冰中含2 mol C-O键 |
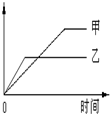 下列表格中的各种情况,可以用图中的图象曲线表示的是( )
下列表格中的各种情况,可以用图中的图象曲线表示的是( )