题目内容
下列说法正确的是( )
| A、常温下,将pH=5的醋酸溶液稀释到原体积的1000倍后,溶液的pH=8 |
| B、为确定某酸H2A是强酸还是弱酸,可测NaHA溶液的pH.若pH>7,则H2A是弱酸;若pH<7,则H2A是强酸 |
| C、由0.1mol?L-1一元碱BOH溶液的pH=10,推知BOH溶液存在BOH?B++OH- |
| D、用0.2000mol?L-1 NaOH标准溶液滴定HCl与CH3COOH的混合液(混合液中两种酸的浓度均约为0.1mol?L-1),至中性时,溶液中的酸恰好被完全中和 |
考点:弱电解质在水溶液中的电离平衡,pH的简单计算
专题:电离平衡与溶液的pH专题
分析:A.酸溶液pH<7;
B.若pH>7,说明HA-水解程度大于电离程度,若pH<7,说明HA-电离程度大于水解程度;
C.0.1mol?L-1一元碱BOH溶液的pH=10,可说明BOH没有完全电离;
D.中和时,酸碱的物质的量相等,但溶液不一定呈中性.
B.若pH>7,说明HA-水解程度大于电离程度,若pH<7,说明HA-电离程度大于水解程度;
C.0.1mol?L-1一元碱BOH溶液的pH=10,可说明BOH没有完全电离;
D.中和时,酸碱的物质的量相等,但溶液不一定呈中性.
解答:
解:A.将pH=5的醋酸溶液稀释到原体积的1000倍后,溶液的pH<7,不可能呈碱性,故A错误;
B.若pH>7,说明HA-水解程度大于电离程度,若pH<7,说明HA-电离程度大于水解程度,不能证明H2A的电离程度,故B错误;
C.0.1mol?L-1一元碱BOH溶液的pH=10,可说明BOH没有完全电离,如完全电离,pH=13,故C正确;
D.中和时,酸碱的物质的量相等,但溶液不一定呈中性,故D错误.
故选C.
B.若pH>7,说明HA-水解程度大于电离程度,若pH<7,说明HA-电离程度大于水解程度,不能证明H2A的电离程度,故B错误;
C.0.1mol?L-1一元碱BOH溶液的pH=10,可说明BOH没有完全电离,如完全电离,pH=13,故C正确;
D.中和时,酸碱的物质的量相等,但溶液不一定呈中性,故D错误.
故选C.
点评:本题考查较为综合,涉及弱电解质的电离等知识,为高考高频考点,侧重于学生的分析能力的考查,注意把握弱电解质的电离特点以及影响因素,难度不大,易错点为B,注意比较的角度.

练习册系列答案
相关题目
正确掌握化学用语和化学基本概念是学好化学的基础.下列有关表述中正确的一组是( )
| A、16O与18O互为同位素;H216O、D216O、H218O、D218O互为同素异形体 |
| B、SiH4、PH3、HCl的稳定性逐渐增强 |
| C、氧化铁的化学式:FeO |
D、Ca2+的结构示意图为 ,NH4Cl的电子式为 ,NH4Cl的电子式为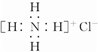 |
下列变化过程中,需要加入还原剂的是( )
| A、HCl→H2 |
| B、FeCl2→FeCl3 |
| C、Na2SO3→SO2 |
| D、Fe→Fe3O4 |
将一定量的锌放入100mL 18.4mol/L的浓硫酸中加热,充分反应后锌完全溶解,同时生成22.4L标况下的气体X,将反应后的溶液稀释至0.8L,测得溶液中H+浓度为0.1mol/L,则下列判断正确的是( )
| A、气体X为SO2 |
| B、气体X为H2 |
| C、气体X为SO2和H2的混合物 |
| D、气体X中SO2和H2的体积相等 |
化学与生活是紧密相联的,下列说法正确的是( )
| A、为防止中秋月饼等富脂食品氧化变质,常在包装袋中放入生石灰 |
| B、发酵粉能使烘焙出的糕点疏松多孔,是因为发酵粉中含有碳酸钠 |
| C、针对甲型H1N1流感的扩散情况,要加强环境、个人等的消毒预防,其中消毒剂常选用含氯消毒剂、双氧水、酒精等适宜的物质 |
| D、加碘食盐中添加碘酸钾而不是碘化钾,是因为碘酸钾能溶于水而碘化钾不溶于水 |
(NH4)2SO4在一定条件下发生如下分解反应:4(NH4)2SO4
N2↑+6NH3↑+3SO2↑+SO3↑+7H2O将反应后的混合气体通入一定量的氯化钡溶液中,下列说法中不正确的是( )
| 高温 |
| A、一定没有亚硫酸钡沉淀 |
| B、一定有硫酸钡沉淀生成 |
| C、得到的沉淀是亚硫酸钡和硫酸钡的混合物 |
| D、逸出的气体是氨气和二氧化硫气体 |
 与
与 也可以发生类似反应①的反应,有机产物的结构简式为:
也可以发生类似反应①的反应,有机产物的结构简式为: