题目内容
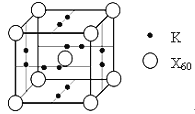
【题目】用如图电解装置将雾霾中的SO2、NO转化为(NH4)2SO4,用其作为一种优良的氮肥。下列有关说法正确的是
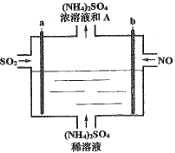
A.每处理lmol NO可以生成2mol A
B.a与电源负极相连,发生还原反应
C.通电后阳极附近溶液的pH增大
D.理论上将SO2与NO以体积比2∶5通入装置可彻底转化
【答案】A
【解析】
该电解池的总反应为:5SO2+2NO+8H2O=(NH4)2SO4+4H2SO4,A为H2SO4。
A.根据总反应可知,每处理lmol NO可以生成2mol H2SO4,故A选;
B.SO2失去电子,在阳极放电,所以a为阳极,与电源正极相连,发生氧化反应,故B不选;
C.阳极是SO2失去电子,电极反应式为:SO2-2e-+2H2O=SO42-+4H+,通电后阳极附近溶液的pH减小,故C不选;
D.根据总反应可知,理论上将SO2与NO以体积比5∶2通入装置可彻底转化,故D不选;
故选A。

【题目】室温下进行下列实验,根据实验操作和现象所得到的结论正确的是
选项 | 实验操作和现象 | 结论 |
A | 向X溶液中滴加 | X溶液中一定含有 |
B | 向浓度均为0.05mol·L-1的 |
|
C | 向2mL浓度均为0.05mol·L-1的 |
|
D | 向 | 结合 |
A.AB.BC.CD.D
【题目】![]() 反应过程的能量变化如图所示,请回答下列问题:
反应过程的能量变化如图所示,请回答下列问题:
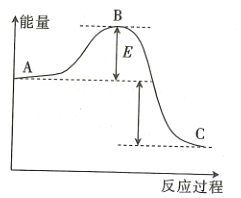
(1)该反应是______________(填“放热”或“吸热”)反应。
(2)用![]() 作该反应的催化剂,A、C两点的能量差是否变化?_____________(填“变化”或“不变”),理由是____________________。
作该反应的催化剂,A、C两点的能量差是否变化?_____________(填“变化”或“不变”),理由是____________________。
(3)在体积为2L的恒容密闭容器中通入2mol![]() 和3mol
和3mol![]() 发生上述反应,10min内
发生上述反应,10min内![]() 的物质的量变化如下表:
的物质的量变化如下表:
反应时间(min) | 0 | 3 | 5 | 7 | 10 |
| 0 | 0.2 | 0.3 | 0.38 | 0.38 |
①升高温度,反应速率______________(填“增大”或“减小”)。
②上述反应在7min时_______________(填“达到”或“未达到”)平衡状态。
③![]() min内,用
min内,用![]() 表示该反应的反应速率为_______________mol·L-1·min-1。
表示该反应的反应速率为_______________mol·L-1·min-1。