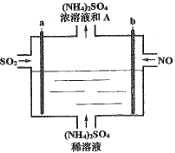
题目内容
【题目】镍及其化合物是重要的合金材料和催化剂。
(1)基态镍原子的价电子排布式为___,它核外有___种运动状态不同的电子。
(2)Ni2+可以形成多种配离子,比如[Ni(NH3)4]2+、[Ni(CN)4]2-等。CN-中碳原子的杂化方式为___,与CN-互为等电子体的一种分子是___。[Ni(NH3)4]2+中H-N-H键角比NH3分子中H-N-H键角___(填“大”、“小”或“相等”),原因是___。
(3)元素铜与镍的第二电离能分别为:I2(Cu)=1958kJ/mol、I2(Ni)=1753kJ/mol,铜的第二电离能更大的原因是___。
(4)NiO的晶体结构如图甲所示,其中离子坐标参数A为(0,0,0),B为(1,1,0),则C离子坐标参数为___。
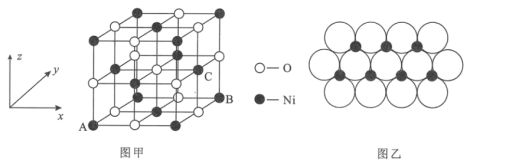
(5)一定温度下,NiO晶体可以自发地分散并形成“单分子层”,可以认为O2-作密置单层排列,Ni2+填充其中(如图乙),已知O2-的半径为apm,设阿伏加德罗常数的值为NA,每平方米面积上分散的该晶体的质量为___g(用含a、NA的代数式表示)。
【答案】3d84s2 28 sp N2或CO 大 NH3中N的孤电子对形成配位键后,使N—H成键电子对所受斥力减小,键角增大 Cu+的价电子排布式为3d10,处于半充满,而Ni+的价电子排布式为3d84s1,因此Cu+比Ni+稳定,更难失电子 (1,![]() ,
,![]() )
) ![]()
【解析】
(1)镍原子的核电荷数为28,基态Ni原子的电子排布式为1s22s22p63s23p63d84s2,原子核外不存在运动状态完全相同的电子;
(2)根据CN-中碳原子的价层电子对数确定杂化方式;原子数目和价电子数相等的微粒互为等电子体;孤对电子与成键电子对之间排斥>成键电子-成键电子排斥,键角被压缩;
(3)核外电子处于半充满、全充满状态时,能量较低较稳定;
(4)NiO的晶体结构如图甲所示,其中离子坐标参数A 为(0,0,0),B为(1,1,0),C在x、y、z轴上的投影分别是1、![]() 、
、![]() ;
;
(5)根据图知,每个Ni原子被3个O原子包围、每个O原子被3个Ni原子包围,如图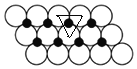 所示,相邻的3个圆中心连线为正三角形,三角形的边长为2apm,每个三角形含有一个Ni原子,三角形的面积=[
所示,相邻的3个圆中心连线为正三角形,三角形的边长为2apm,每个三角形含有一个Ni原子,三角形的面积=[![]() ×2a×2a×sin60°×10-24]m2=
×2a×2a×sin60°×10-24]m2=![]() ×10-24a2m2,如图
×10-24a2m2,如图 实际上每个Ni原子被两个小三角形包含小平行四边形面积为2
实际上每个Ni原子被两个小三角形包含小平行四边形面积为2![]() ×10-24a2m2,O原子个数=
×10-24a2m2,O原子个数=![]() ×6=1,由此计算每平方米面积上分散的该晶体的质量。
×6=1,由此计算每平方米面积上分散的该晶体的质量。
(1)镍原子的核电荷数为28,基态Ni原子的电子排布式为1s22s22p63s23p63d84s2,则价电子排布式为3d84s2;原子核外不存在运动状态完全相同的电子,则Ni核外有28种运动状态不同的电子;
(2)CN-中碳原子的价层电子对数目为1+![]() =2,则碳原子的杂化方式为sp;CN-的原子数目为2,价电子数为10,则与CN-互为等电子体的一种分子是N2或CO;NH3分子中N原子有1个孤对电子,[Ni(NH3)4]2+中NH3中N的孤电子对形成配位键后,使N—H成键电子对所受斥力减小,键角增大,则[Ni(NH3)4]2+中H-N-H键角大于NH3分子中H-N-H键角;
=2,则碳原子的杂化方式为sp;CN-的原子数目为2,价电子数为10,则与CN-互为等电子体的一种分子是N2或CO;NH3分子中N原子有1个孤对电子,[Ni(NH3)4]2+中NH3中N的孤电子对形成配位键后,使N—H成键电子对所受斥力减小,键角增大,则[Ni(NH3)4]2+中H-N-H键角大于NH3分子中H-N-H键角;
(3)Cu+的价电子排布式为3d10,处于全充满,而Ni+的价电子排布式为3d84s1,因此Cu+比Ni+稳定,更难失电子,所以铜的第二电离能较大;
(4)NiO的晶体结构如图甲所示,其中离子坐标参数A 为(0,0,0),B为(1,1,0),C在x、y、z轴上的投影分别是1、![]() 、
、![]() ,所以C的晶胞参数为(1,
,所以C的晶胞参数为(1,![]() ,
,![]() );
);
(5)根据图知,每个Ni原子被3个O原子包围、每个O原子被3个Ni原子包围,如图 所示,相邻的3个圆中心连线为正三角形,三角形的边长为2apm,每个三角形含有一个Ni原子,三角形的面积=[
所示,相邻的3个圆中心连线为正三角形,三角形的边长为2apm,每个三角形含有一个Ni原子,三角形的面积=[![]() ×2a×2a×sin60°×10-24]m2=
×2a×2a×sin60°×10-24]m2=![]() ×10-24a2m2,如图
×10-24a2m2,如图 实际上每个Ni原子被两个小三角形包含小平行四边形面积为2
实际上每个Ni原子被两个小三角形包含小平行四边形面积为2![]() ×10-24a2m2,O原子个数=
×10-24a2m2,O原子个数=![]() ×6=1,每平方米面积上分散的该晶体的质量=
×6=1,每平方米面积上分散的该晶体的质量=![]() =
=![]() g。
g。

 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案