题目内容
【题目】甲醇是重要的化工原料。利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主要反应如下:
①CO(g)+2H2(g)![]() CH3OH(g) △H1
CH3OH(g) △H1
②CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H2=-58 kJ/mol
CH3OH(g)+H2O(g) △H2=-58 kJ/mol
③CO2(g)+H2(g)![]() CO(g)+H2O(g) △H3=+41 kJ/mol
CO(g)+H2O(g) △H3=+41 kJ/mol
回答下列问题:
(1)CO2的电子式是 。
(2)△H1= kJ/mol,①反应正向的熵变△S 0(填>、<或=)。
(3)在容积为2L的密闭容器中,充入一定量CO2和H2合成甲醇(上述②反应),在其他条件不变时,温度T1、T2对反应的影响图像如图,下列说法正确的是__________(填序号)
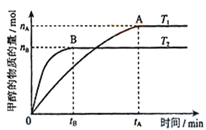
①温度为T1时,从反应到平衡,生成甲醇的平均速率为:v(CH3OH)=nA/tA mol/(L·min)
②当v(CH3OH) = v(H2O)时,说明反应达到平衡
③混合气体的平均相对分子质量A点大于B点
④处于A点的反应体系从T1变到T2,达到平衡时n(H2)与n(CH3OH)比值增大
(4)在T1温度时,将2molCO2和6molH2充入2L密闭容器中,充分反应(上述②反应)达到平衡后,若CO2转化率为50%,,则容器内的压强与起始压强之比为__________;T1温度,反应CH3OH(g)+H2O(g)![]() CO2(g)+3H2(g)的平衡常数数值为__________。
CO2(g)+3H2(g)的平衡常数数值为__________。
【答案】(1)![]() ;
;
(2)-99;<
(3)③④
(4)3:4;6.75或27/4
【解析】
试题分析:(1)CO2的电子式为![]() ,故答案为:
,故答案为:![]() ;
;
(2)①CO(g)+2H2(g) ![]() CH3OH(g) △H1,②CO2(g)+3H2(g)
CH3OH(g) △H1,②CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) △H2=-58 kJ/mol,③CO2(g)+H2(g)
CH3OH(g)+H2O(g) △H2=-58 kJ/mol,③CO2(g)+H2(g) ![]() CO(g)+H2O(g) △H3=+41 kJ/mol,根据盖斯定律:反应②-反应③=反应①,故△H1=△H2-△H3=-99 kJ/mol,反应①中气体的物质的量减少,属于熵减小的反应,故答案为:-99;<;
CO(g)+H2O(g) △H3=+41 kJ/mol,根据盖斯定律:反应②-反应③=反应①,故△H1=△H2-△H3=-99 kJ/mol,反应①中气体的物质的量减少,属于熵减小的反应,故答案为:-99;<;
(3)①温度为T1时,从反应到平衡,生成甲醇的平均速率为:v(CH3OH)=![]() =nA/2tA mol/(L·min),错误;②根据CO2+3H2
=nA/2tA mol/(L·min),错误;②根据CO2+3H2![]() CH3OH+H2O,如何时刻都存在v(CH3OH) = v(H2O)时,不能说明反应达到平衡,错误;③该反应属于气体的物质的量减少的反应,甲醇的物质的量越多,混合气体的物质的量越少,混合气体的平均相对分子质量越大,混合气体的平均相对分子质量A点大于B点,正确;④处于A点的反应体系从T1变到T2,平衡向逆反应方向移动,达到平衡时n(H2)与n(CH3OH)比值增大,正确;故选③④;
CH3OH+H2O,如何时刻都存在v(CH3OH) = v(H2O)时,不能说明反应达到平衡,错误;③该反应属于气体的物质的量减少的反应,甲醇的物质的量越多,混合气体的物质的量越少,混合气体的平均相对分子质量越大,混合气体的平均相对分子质量A点大于B点,正确;④处于A点的反应体系从T1变到T2,平衡向逆反应方向移动,达到平衡时n(H2)与n(CH3OH)比值增大,正确;故选③④;
(4)温度T2先达到平衡,则温度T2>T1,又温度高时平衡状态CH3OH的物质的量少,则说明升高温度,可逆反应CO2+3H2![]() CH3OH+H2O向逆反应方向移动,故正反应为放热反应;
CH3OH+H2O向逆反应方向移动,故正反应为放热反应;
CO2转化率为50%,转化的二氧化碳为1mol,则:
CO2 (g)+3H2(g)![]() CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)
起始(mol):2 6 0 0
变化(mol):1 3 1 1
平衡(mol):1 3 1 1
相同条件下,气体的压强之比等于物质的量之比,则容器内的压强与起始压强之比为=![]() =
=![]() ,平衡常数=
,平衡常数=![]() =
=![]() =
=![]() ,CH3OH(g)+H2O(g)
,CH3OH(g)+H2O(g)![]() CO2(g)+3H2(g)的平衡常数与CO2+3H2
CO2(g)+3H2(g)的平衡常数与CO2+3H2![]() CH3OH+H2O的平衡常数互为倒数,因此CH3OH(g)+H2O(g)
CH3OH+H2O的平衡常数互为倒数,因此CH3OH(g)+H2O(g)![]() CO2(g)+3H2(g)的平衡常数=
CO2(g)+3H2(g)的平衡常数=![]() ,故答案为:
,故答案为:![]() ;
;![]() 。
。

 阅读快车系列答案
阅读快车系列答案