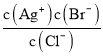��Ŀ����
����Ŀ����Ҫ��ش��������⣺
(1)Ũ��Ϊ0.1mol/L��������Һ�������غ����ʽΪ___________��
(2)��Ũ�ȵ�NaHCO3��Na2CO3�����Һ�е������غ����ʽΪ____________��
(3) Ũ��Ϊ0.1mol/LNa2CO3��Һ����غ����ʽΪ__________��
(4) ��ĭ��������ʱ������Ӧ�����ӷ�����______________��
(5)�����£�NaHSO3��Һ������Ũ���ɴ�С��˳��_________��
(6)��pH��8��Ba(OH)2��Һ��pH��5��ϡ�����ϣ���������100 ��ĺ��¡���ʹ�����Һ��pH��7����Ba(OH)2��Һ������������Ϊ________��(��֪100�棬KW=1.0��10-12)
���𰸡�c(CH3COOH)+c(H+)=c(OH-) 2c(Na+)=3c(H2CO3)+ 3c(CO32-)+3c(HCO3-) c(Na��)��c(H��)��c(HCO3-)��2c(CO32-)��c(OH��) Al3++ 3HCO3- = Al(OH)3�� +CO2 �� c(Na +)��C(HSO3-)��C(H+)��c(SO32��) �� c(OH��) ��C(H2SO3) 2:9
��������
������Һ�����ӵĵ���غ㡢�����غ�������غ���ɷ�����𣻸���˫ˮ��ԭ��������𣻸�����Ӧ��ˮ�����ӻ���������Һ��pH��
��1����������Һ��������������Դ��ˮ�ĵ���ʹ�������ӵ�ˮ�⣬��c(OH-)=c(CH3COOH)+c(H+)���ʴ�Ϊ��c(CH3COOH)+c(H+)=c(OH-)��
��2��NaHCO3��Һ�д��ڵ������غ��ϵΪ��c(Na+)=c(H2CO3)+ c(CO32-)+c(HCO3-)��Na2CO3��Һ�д��ڵ������غ��ϵΪ��c(Na+)=2c(H2CO3)+ 2c(CO32-)+2c(HCO3-)�����Ũ�ȵĻ����Һ�У�2c(Na+)=3c(H2CO3)+ 3c(CO32-)+3c(HCO3-)���ʴ�Ϊ��2c(Na+)=3c(H2CO3)+ 3c(CO32-)+3c(HCO3-)��
��3�������ӡ�������ֻ��һ������ɣ�̼��������ӡ����������Ӵ�һ������ɣ�̼������Ӵ�2������ɣ����Ե���غ����ʽΪ��c(Na��)��c(H��)��c(HCO3-)��2c(CO32-)��c(OH��)��
��4����ĭ�����������������̼�����ƣ������Ӻ�̼��������ӷ���˫ˮ�ⷴӦ����ٽ����������������Ͷ�����̼�����ӷ�����Al3++ 3HCO3- = Al(OH)3�� +CO2�����ʴ�Ϊ��Al3++ 3HCO3- = Al(OH)3�� +CO2 ����
��5��NaHSO3��ȫ�������������Ӻ�����������ӣ�����������ӵĵ���̶ȴ���ˮ��̶ȣ���������Ũ�ȴ�СΪ��c(Na +)��C(HSO3-)��C(H+)��c(SO32��) �� c(OH��) ��C(H2SO3)���ʴ�Ϊ��c(Na +)��C(HSO3-)��C(H+)��c(SO32��) �� c(OH��) ��C(H2SO3)��
��6��pH=5��ϡ������Һc��H+��=10-5mol/L��pH=8��Ba(OH)2��Һ��c��OH-��=![]() =10-4mol/L�������Һ��pH��7����ʼ��ԣ����������ʱc(OH-)=
=10-4mol/L�������Һ��pH��7����ʼ��ԣ����������ʱc(OH-)=![]() =10-5mol/L=
=10-5mol/L=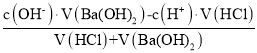 =
=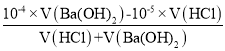
�����![]() ���ʴ�Ϊ��2:9��
���ʴ�Ϊ��2:9��

 ��ڽ��ȫ������ϵ�д�
��ڽ��ȫ������ϵ�д�����Ŀ��CO��H2����Ϊ�ϳ������úϳ������Ժϳ����ᡣ�ش��������⣺
(1)��֪CO��H2��CH3COOH��ȼ������H�ֱ�Ϊ-283.0kJ/mol��-285.8kJ/mol��-1255.0kJ/mol�����úϳ����ϳ�CH3COOH(l)�Ŀ�����̵��Ȼ�ѧ��Ӧ����ʽΪ___________________________________________��
(2)���ܱ������з����ϳ�����ķ�Ӧ�����п������CH3COOH���ʵĴ�ʩ��________��
A�����º��ݣ�ͨ���������� B.��ʱ�������������
C�������Ч���� D��ѹ���������
(3)��150��ʱ��2L���ܱ������з�����Ӧ��
2H2(g)+2CO(g)![]() CH3COOH(g) ��H>0����ʼͨ��4molH2��4molCO��CH3COOH������Ũ��������ʱ��仯���±���ʾ��
CH3COOH(g) ��H>0����ʼͨ��4molH2��4molCO��CH3COOH������Ũ��������ʱ��仯���±���ʾ��
ʱ��/min | 0 | 2 | 4 | 6 | 8 |
c(CH3COOH)/mol/L | 0 | 0.3 | 0.5 | 0.6 | 0.6 |
��0~2min����CO��ʾ�÷�Ӧ������Ϊ_________________�����ŷ�Ӧ�Ľ������������Ŀ���ԭ����____________________________________________________��
��150��ʱ�÷�Ӧ��ƽ�ⳣ������ֵԼΪ_________��������������һλС����
��ƽ�����ͨ��1molH2����CH3COOH(g)���������________�����ٴ�ͨ��1molH2��1molCO����CH3COOH(g)���������_________�����������С�����ߡ����䡱��
(4)һ���¶��£��ݻ���Ϊ1L�������ܱ�����֮�н�������ʵ�飺
ʵ���� | ��ʼͶ�� |
�� | 2molH2��2molCO |
�� | 1molCH3COOH(g) |
��ʵ�����H2��ʵ�����CH3COOH��ת������ʱ��仯ͼʾ���£�
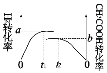
��a+b=_______���ﵽƽ���ʱ���С��ϵΪt1__________t2�����>����<������ȷ������