题目内容
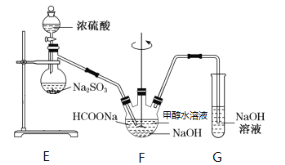
【题目】某同学通过以下流程制取 NaClO2晶体:
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
已知:ClO2浓度过高时易发生分解,NaClO2高于60 ℃时易分解, NaClO2 饱和溶液在低于38 ℃时析出NaClO2·3H2O,高于38 ℃时析出 NaClO2。
下列说法不正确的是( )
A.步骤①中工业常用H2C2O4代替Na2SO3
B.步骤②发生反应的离子方程式为2ClO2+2OH-+H2O2===2ClO2-+O2+2H2O
C.步骤③的结晶方法为:蒸发浓缩,冷却结晶
D.步骤④中制得的NaClO2晶体中可用略高于38 ℃的热水洗涤2~3遍
【答案】C
【解析】
A项、步骤①中Na2SO3作为还原剂,H2C2O4也是常见的还原剂,工业常用H2C2O4代替Na2SO3,故A正确;
B项、步骤②发生的反应为碱性条件下ClO2与双氧水发生氧化还原反应生成ClO2-、O2和H2O,反应的离子方程式为 2ClO2+2OH-+H2O2=2ClO![]() +O2+2H2O,故B正确;
+O2+2H2O,故B正确;
C项、由于NaClO2高于60 ℃时易分解,因此结晶方法不可以用蒸发浓缩和冷却结晶的方法,应该用减压蒸发的办法,故C错误;
D项、由于NaClO2饱和溶液在低于38 ℃时析出NaClO2·3H2O,高于38 ℃时析出 NaClO2,步骤④中制得的NaClO2晶体中可用略高于38 ℃的热水洗涤2~3遍,故D正确;
故选C。

练习册系列答案
 名牌中学课时作业系列答案
名牌中学课时作业系列答案 明天教育课时特训系列答案
明天教育课时特训系列答案 浙江新课程三维目标测评课时特训系列答案
浙江新课程三维目标测评课时特训系列答案 周周清检测系列答案
周周清检测系列答案
相关题目