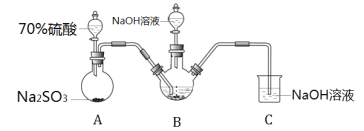
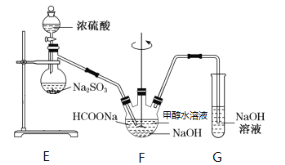
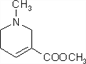
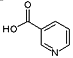
题目内容
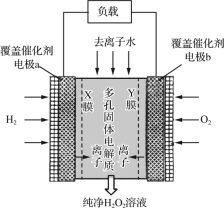
【题目】下图是CO2电催化还原为CH4的工作原理示意图。下列说法不正确的是( )
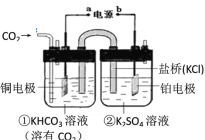
A.该过程是电能转化为化学能的过程
B.铜电极为阴极,发生还原反应
C.一段时间后,①池中n(KHCO3)不变
D.一段时间后,②池中溶液的pH一定下降
【答案】C
【解析】
A、装置中有外电源,属于电解装置,该过程是电能转化为化学能的过程,故A正确;
B、Cu电极上二氧化碳得电子生成甲烷,则铜电极的电极反应式为 CO2+8H++8e-=CH4+2H2O,铜电极为阴极,发生还原反应,故B正确;
C、在电解池的阴极上发生二氧化碳得电子的还原反应,即CO2+8H++8e-═CH4+2H2O,一段时间后,氢离子减小,氢氧根浓度增大,氢氧根会和①池中的碳酸氢钾反应,所以n(KHCO3)会减小,故C错误;
D、在电解池的阳极上,是阴离子氢氧根离子发生失电子的氧化反应,所以氢氧根离子的浓度减小,则pH一定下降,故D正确。
故选:C。

练习册系列答案
相关题目