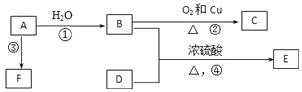
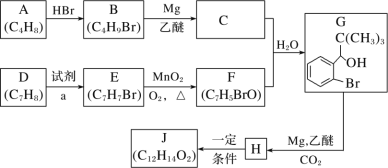
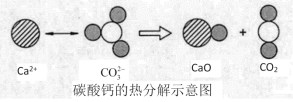
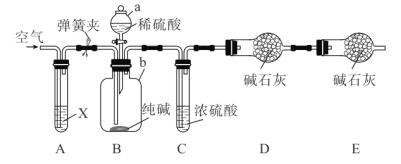
题目内容
【题目】在一定温度下,可逆反应A(g)+3B(g)2C(g)达到平衡的标志是
A.A、B、C的浓度不再变化
B.A、B、C的物质的量之比为1:3:2
C.单位时间内生成1mol A的同时生成3mol B
D.2υ正(B)= 3υ逆(C)
【答案】AD
【解析】
可逆反应达到平衡状态时,正逆反应速率相等,反应体系中各物质的物质的量、物质的量浓度、百分含量都不变,以及由此引起的一系列物理量不变,据此分析解答。
A.可逆反应达到平衡状态时,正逆反应速率相等,则反应体系中各物质浓度不变,所以当A、B、C的浓度不再变化时该反应达到平衡状态,故A正确;
B.当A、B、C的浓度之比为1:3:2时,该反应可能达到平衡状态也可能不达到平衡状态,与反应物初始浓度及转化率有关,所以不能据此判断平衡状态,故B错误;
C.无论反应是否达到平衡状态,都存在单位时间内生成1molA,同时生成3molB,所以不能据此判断平衡状态,故C错误;
D.2υ正(B)= 3υ逆(C),即![]() ,不同物质的正逆反应速率之比等于计量系数值比,能据此判断反应达到平衡状态,故D正确;
,不同物质的正逆反应速率之比等于计量系数值比,能据此判断反应达到平衡状态,故D正确;
答案选AD。

练习册系列答案
相关题目