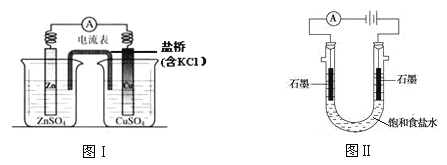
题目内容
【题目】下列图示与对应的叙述不相符合的是( )
A.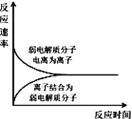 表示弱电解质在水中建立电离平衡的过程
表示弱电解质在水中建立电离平衡的过程
B.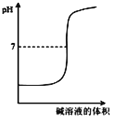 表示强碱滴定强酸的滴定曲线
表示强碱滴定强酸的滴定曲线
C.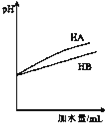 表示等体积等pH的弱酸HA和强酸HB加水稀释过程中的pH变化趋势
表示等体积等pH的弱酸HA和强酸HB加水稀释过程中的pH变化趋势
D.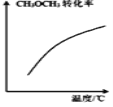 表示密闭容器中
表示密闭容器中![]() 达到平衡后,恒压升高温度过程中,
达到平衡后,恒压升高温度过程中,![]() 的转化率变化趋势
的转化率变化趋势
【答案】C
【解析】
A.弱电解质存在电离平衡,平衡时正逆反应速率相等,图象符合电离特点,故A正确;
B.强碱滴定强酸,溶液pH增大,存在pH的突变,图象符合,故B正确;
C.等体积等pH的弱酸HA和强酸HB加水稀释相同倍数,弱酸HA的pH变化小,强酸HB的pH变化大,图象不符合,故C错误;
D.密闭容器中![]()
![]()
![]() ,恒压升高温度过程中平衡正向进行,
,恒压升高温度过程中平衡正向进行,![]() 的转化率变化趋势随温度升高而增大,故D正确;
的转化率变化趋势随温度升高而增大,故D正确;
故选C。

【题目】某化学小组为了研究外界条件对化学反应速率的影响,进行了酸性高锰酸钾与草酸的反应,记录以下实验数据(已知![]() 为阿伏伽德罗常数的值):
为阿伏伽德罗常数的值):
试管中所加试剂及其用量/mL | 溶液退至无色所需时间/min | |||||
实验编号 | 实验温度/℃ | 0.6 mol/LH2C2O4溶液 | H2O | 3 mol/LH2SO4溶液 | 0.05 mol/LKMnO4溶液 | |
① | 25 | 3.0 | v1 | 2.0 | 3.0 | 1.5 |
② | 25 | 2.0 | 3.0 | 2.0 | 3.0 | 2.7 |
③ | 50 | 2.0 | v2 | 2.0 | 3.0 | 1.0 |
(1)请写出该反应的离子方程式:___,当该反应以实验①中数据反应完全时转移电子数为_____![]() 。
。
(2)实验①②是探究浓度对反应速率的影响,实验②③时探究温度对反应速率的影响,则表中V1=_______,V2=__________。
(3)根据实验①、②的数据,可以得到的结论是____。
(4)该小组同学根据经验绘制了n(Mn2+)随时间变化的趋势如图1所示,但有同学查阅已有的实验资料发现,该实验过程中n(Mn2+)随时间变化的实际趋势如图2所示。

该小组同学根据上述信息提出了新的假设,并设计一下实验方案继续进行实验探究。
实验编号 | 实验温度/℃ | 试管中所加试剂及其用量/ml | 再加入某种固体 | 溶液退至无色所需时间/min | |||
0.6 mol/LH2C2O4溶液 | H2O | 3 mol/LH2SO4溶液 | 0.05 mol/L KMnO4 溶液 | ||||
④ | 25 | 3.0 | 2.0 | 2.0 | 3.0 | MnSO4 | t |
①该小组同学提出的新假设是__________。
②若该小组同学提出的假设成立,应观察到__________(填实验现象)。
【题目】某兴趣小组利用文献资料设计方案对氯及其化合物进行探究。
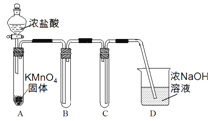
Ⅰ.用高锰酸钾和浓盐酸反应制取氯气
(1)该小组利用右图装置及试剂制备并收集适量Cl2,装置B、C的作用分别是___________、_______________。
(2)制得的氯气中加入适量水,得到饱和氯水,饱和氯水中含氯元素的微粒有____________(写出全部微粒)。
(3)饱和氯水与石灰石的反应是制取较浓HC1O溶液的方法之一。在过量的石灰石中加入饱和氯水充分反应,有少量气泡产生,溶液浅黄绿色褪去,过滤,得到的滤液其漂白性比饱和氯水更强。
①滤液漂白性增强的原因是________________(用化学平衡移动原理解释)。
②饱和氯水与石灰石反应生成HC1O的方程式是___________________。
Ⅱ. ClO3—、Cl—和H+反应的探究
(4)KClO3、KCl与硫酸可以反应。该小组设计了系列实验研究反应条件对反应的影响,实验记录如下(实验在室温下进行):
烧杯编号 | 1 | 2 | 3 | 4 |
氯酸钾饱和溶液 | 1mL | 1mL | 1mL | 1mL |
氯化钾固体 | 1g | 1g | 1g | 1g |
水 | 8mL | 6mL | 3mL | 0mL |
硫酸(6mol/L) | 0mL | 2mL | (____)mL | 8mL |
现象 | 无现象 | 溶液呈浅黄色 | 溶液呈黄绿色,生成浅黄绿色气体 | 溶液呈黄绿色, |
①该系列实验的目的_______________________。
②烧杯3取用硫酸的体积应为______________mL。
(5)该小组同学查资料得知:将氯酸钾固体和浓盐酸混合也能生成氯气,同时有大量ClO2生成;ClO2沸点为10℃,熔点为-59℃,液体为红色;Cl2沸点为-34℃,液态为黄绿色。设计最简单的实验验证Cl2中含有ClO2______________________。
【题目】氮的固定和氮的循环是几百年来科学家一直研究的课题。
(1)下表列举了不同温度下大气固氮和工业固氮的部分K 值。
反应 | 大气固氮N2(g)+O2(g) | 工业固氮N2(g)+3H2(g) | |||
温度/℃ | 27 | 2000 | 25 | 400 | 450 |
K | 3.84×10-31 | 0.1 | 5×108 | 0.507 | 0.152 |
①分析数据可知:人类不适合大规模模拟大气固氮的原因____。
②从平衡视角考虑工业固氮应该选择常温条件,但实际工业生产却选择 500℃左右的高温, 解释其可能的原因_____。
(2)工业固氮反应中,在其他条件相同时,分别测定 N2 的平衡转化率在不同压强(р1、р2)下随温度变化的曲线,下图所示的图示中,正确的是_____(填“A”或“B”);比较р1、р2的大小关系_____。
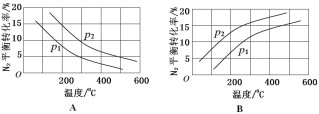
(3)下图是某压强下,N2 与H2 按体积比1∶3投料时,反应混合物中氨的体积分数随温度的变化曲线。其中一条是经过一定时间反应后的曲线,另一条是平衡时的曲线。
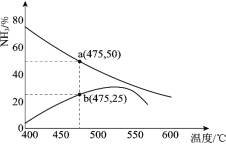
①图中b 点,v(正)_____v(逆)。(填“>”、“=”或“<”)
②图中a 点,容器内气体 n(N2):n(NH3)=_____。
(4)已知:N2(g)+3H2(g)![]() 2NH3(g)△H=-92.4kJ·mol-1;2H2(g) +O2(g)
2NH3(g)△H=-92.4kJ·mol-1;2H2(g) +O2(g)![]() 2H2O(l)△H=-575.6kJ·mol-1;近年,又有科学家提出在常温、常压、催化剂等条件下氮气与液态水合成氨气,同时产生氧气的新思路,则该反应的热化学反应方程式为:_____。
2H2O(l)△H=-575.6kJ·mol-1;近年,又有科学家提出在常温、常压、催化剂等条件下氮气与液态水合成氨气,同时产生氧气的新思路,则该反应的热化学反应方程式为:_____。
(5)NH3在一定条件下可被氧化。
已知:ⅰ.4NH3(g)+3O2(g)=2N2(g)+6H2O(g)ΔH=﹣1298kJ/mol
ⅱ.
① 断开 1 mol H-O 键与断开 1 mol H-N 键所需能量相差约_____kJ;
② H-O 键比 H-N 键(填“强”或“弱”)_____。