题目内容
在一定温度下,容器内某一反应中两种气态物质M、N的物质的量随反应时间变化的曲线如图,下列表述中正确的是( )
A.反应的化学方程式为:2M N N |
| B.t2时,正逆反应速率相等,反应达到平衡状态 |
| C.t3时,M上a点正反应速率等于N上b点的逆反应速率 |
D.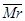 混一定时,N的体积百分含量也一定 混一定时,N的体积百分含量也一定 |
D
解析试题分析:A. 由图象可以看出,反应中N的物质的量减小,M的物质的量增多,则N为反应物,M为生成物,
且△n(N):△n(M)=6mol:3mol=2:1,则反应的化学方程式为:2N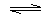 M,
M,
故答案为:2N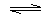 M;故A错误。B. t2时刻,反应没有达到平衡状态,N的物质的量继续减小,则反应向正反应方向移动,故B错误。C选项a点是逆反应速率,b是正反应速率,故C错误。D
M;故A错误。B. t2时刻,反应没有达到平衡状态,N的物质的量继续减小,则反应向正反应方向移动,故B错误。C选项a点是逆反应速率,b是正反应速率,故C错误。D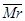 混一定时说明各物质的浓度保持不变,故D正确
混一定时说明各物质的浓度保持不变,故D正确
考点:考查化学反应速率和化学平衡的相关知识点。

甲烷和氨在国民经济中占有重要地位。
(1)制备合成氨原料气H2,可用甲烷蒸汽转化法,主要转化反应如下:
CH4(g) + H2O(g)  CO(g) + 3H2(g) ΔH =" +206.2" kJ/mol
CO(g) + 3H2(g) ΔH =" +206.2" kJ/mol
CH4(g) + 2H2O(g)  CO2(g) +4H2(g) ΔH = +165.0kJ/mol
CO2(g) +4H2(g) ΔH = +165.0kJ/mol
上述反应所得原料气中的CO能使氨合成催化剂中毒,必须除去。工业上常采用催化剂存在下CO与水蒸气反应生成易除去的CO2,同时又可制得等体积的氢气的方法。此反应称为一氧化碳变换反应,该反应的热化学方程式是 。
(2)工业生产尿素的原理是以NH3和CO2为原料合成尿素[CO(NH2)2],反应的化学方程式为:2NH3 (g)+ CO2 (g)  CO(NH2)2 (l) + H2O (l),该反应的平衡常数和温度关系如下:
CO(NH2)2 (l) + H2O (l),该反应的平衡常数和温度关系如下:
| T / ℃ | 165 | 175 | 185 | 195 |
| K | 111.9 | 74.1 | 50.6 | 34.8 |
① 反应热ΔH(填“>”、“<”或“=”)_______0。
② 在一定温度和压强下,若原料气中的NH3和CO2的物质的量之比(氨碳比)
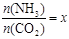 ,下图是氨碳比(x)与CO2平衡转化率(α)的关系。求图中的B点处,NH3的平衡转化率。
,下图是氨碳比(x)与CO2平衡转化率(α)的关系。求图中的B点处,NH3的平衡转化率。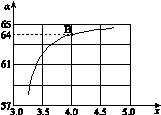
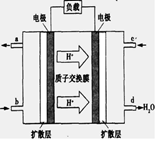
(3)已知甲烷燃料电池的工作原理如下图所示。该电池工作时,a口放出的物质为_________,该电池正极的电极反应式为:____ ,工作一段时间后,当3.2g甲烷完全反应生成CO2时,有 mol 电子发生转移。
工业炼铁是在高炉中进行的,高炉炼铁的主要反应是:① 2C(焦炭)+O2(空气)=2CO;② Fe2O3+3CO=2Fe+3CO该炼铁工艺中,对焦炭的实际使用量要远远高于按照化学方程式计算所需其主要原因是
| A.CO过量 | B.CO与铁矿石接触不充分 |
| C.炼铁高炉的高度不够 | D.CO与Fe2O3的反应有一定限度 |
在恒容密闭容器中,一定条件下进行如下反应:NO(g)+CO(g) 
 N2(g)+CO2(g);△H=-373.2kJ·mol-1 ,达到平衡后,为提高该反应的速率和NO的转化率,采取的正确措施是
N2(g)+CO2(g);△H=-373.2kJ·mol-1 ,达到平衡后,为提高该反应的速率和NO的转化率,采取的正确措施是
| A.加催化剂同时升高温度 | B.加催化剂同时增大压强 |
| C.温度不变同时充入Ar | D.降低温度同时增大压强 |
决定化学反应速率的主要因素是
| A.催化剂 | B.参加反应的物质本身的性质 |
| C.反应物的浓度 | D.温度、压强以及反应物的接触面 |
一定条件下,可逆反应:X(g) + 3Y(g) 2Z(g),若X、Y、Z的起始浓度分别为c1、c2、c3(均不为零),反应达到平衡时, X、Y、Z的浓度分别为0.1mol?L-1、0.3 mol?L-1、0.08 mol?L-1,则下列判断不正确的是 ( )
2Z(g),若X、Y、Z的起始浓度分别为c1、c2、c3(均不为零),反应达到平衡时, X、Y、Z的浓度分别为0.1mol?L-1、0.3 mol?L-1、0.08 mol?L-1,则下列判断不正确的是 ( )
| A.c1∶c2="=" 1∶3 | B.平衡时,Y和Z生成速率之比为3∶2 |
| C.X、Y的转化率不相等 | D.c1的取值范围为0< c1< 0.14 mol?L-1 |
 2Q(g)
2Q(g)