题目内容
6.近期因“召回门”而闹的沸沸扬扬的丰田Prius属第三代混合动力车,可以用电动机、内燃机或二者结合推动车轮.汽车上坡或加速时,电动机提供推动力,降低了汽油的消耗;在刹车和下坡时电动机处于充电状态.
(1)混合动力车的内燃机以汽油为燃料,汽油(以辛烷C8H18计)和氧气充分反应,每生成1mol水蒸气放热569.1kJ.则该反应的热化学方程式为C8H18(l)+25/2O2(g)=8CO2(g)+9H2O(g)△H=-5121.9 kJ•mol-1.
(2)混合动力车的电动机目前一般使用的是镍电池,镍氢电池采用镍的化合物为正极,储氢金属(以M表示)为负极,碱液(主要为KOH)为电解液.镍氢电池充放电原理示意如图,其总反应式是H2+2NiOOH$?_{充电}^{放电}$2Ni(OH)2.根据所给信息判断,混合动力车上坡或加速时,乙电极周围溶液的pH将增大(填“增大”、“不变”或“减小”),该电极的电极反应式为NiOOH+H2O+e-=Ni(OH)2+OH-.
分析 (1)根据生成1mol水蒸气放热569.1kJ计算生成9 mol水蒸气放出的热量,然后书写热化学反应方程式;
(2)据图分析放电时的总反应方程式,放电过程为原电池,根据乙中的电极反应来分析pH.
解答 解:(1)汽油燃烧的方程式为C8H18+25/2O2=8CO2+9H2O,生成1mol水蒸气放热569.1 kJ,故生成9 mol水蒸气放热569.1 kJ×9=5121.9 kJ,
其热化学方程式为C8H18(l)+$\frac{25}{2}$O2(g)=8CO2(g)+9H2O(g)△H=-5121.9 kJ•mol-1,
故答案为:C8H18(l)+25/2O2(g)=8CO2(g)+9H2O(g)△H=-5121.9 kJ•mol-1;
(2)混合动力车上坡或加速时,电动机提供推动力,是电池放电,由图转化关系可知,NiOOH转变为Ni(OH)2,总反应方程式为H2+2NiOOH$?_{充电}^{放电}$2Ni(OH)2,电极反应式为NiOOH+H2O+e-=Ni(OH)2+OH-,乙电极周围因氢氧根离子的浓度增大,故pH将增大,
故答案为:H2+2NiOOH$?_{充电}^{放电}$2Ni(OH)2;增大;NiOOH+H2O+e-=Ni(OH)2+OH-.
点评 本题考查了热化学方程式书写、原电池与电解池的工作原理等重点知识,关键问题在于知识的理解和运用.并注意化学反应原理是高考中的重要考点,核心知识为热化学方程式、原电池与电解池的工作原理等问题,复习过程中要加强重视程度,以理解方法、原理为主.

练习册系列答案
相关题目
11.下列说法正确的是( )
| A. | 每一周期元素都是从碱金属开始,以稀有气体结束 | |
| B. | f区都是副族元素,s区和p区的都是主族元素 | |
| C. | 铝的第一电离能大于钾的第一电离能 | |
| D. | 同周期元素从左到右电负性逐渐减小 |
12. 某温度下,对于反应N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol.N2的平衡转化率(α)与体系总压强(P)的关系如图所示.下列说法正确的是( )
某温度下,对于反应N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol.N2的平衡转化率(α)与体系总压强(P)的关系如图所示.下列说法正确的是( )
 某温度下,对于反应N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol.N2的平衡转化率(α)与体系总压强(P)的关系如图所示.下列说法正确的是( )
某温度下,对于反应N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol.N2的平衡转化率(α)与体系总压强(P)的关系如图所示.下列说法正确的是( )| A. | 将1.0 mol氮气、3.0 mol氢气,置于1 L密闭容器中发生反应,放出的热量为 92.4 kJ | |
| B. | 平衡状态由A变到B时,平衡常数K (A)<K (B) | |
| C. | 上述反应在达到平衡后,增大压强,H2的转化率提高 | |
| D. | 升高温度,平衡向逆反应方向移动,说明逆反应速率增大,正反应速度减小 |
9.除去Cu粉中的Al粉不能用( )
| A. | 加入稀H2SO4,过滤 | B. | 加入NaCl溶液,过滤 | ||
| C. | 加入NaOH溶液,过滤 | D. | 加入CuSO4溶液,过滤 |
1.下列说法正确的是(NA表示阿伏加德罗常数的值)( )
| A. | 1 mol聚乙烯含有的原子数目为6NA | |
| B. | 标况下1 L己烷完全燃烧后恢复至原状态,生成气态物质分子数为6NA/22.4 | |
| C. | 1 mol甲基含7 NA个电子 | |
| D. | 2.8 g乙烯和丙烯的混合气体中所含碳原子数为0.2NA |
11.下表中列出五种短周期元素A、B、C、D、E的信息,请推断后回答:
(1)写出C元素在周期表中的位置第三周期ⅦA族,写出D元素最高价氧化物的水化物电子式 ;
;
(2)写出B单质与水反应的离子方程式Cl2+H2O=Cl-+H++HClO;
(3)元素A和D形成的某种化合物可作为呼吸面具中氧气的来源,写出得到氧气反应的主要化学方程式2Na2O2+2CO2═2Na2CO3+O2;
(4)已知E元素的某种氢化物Y与A2的摩尔质量相同,Y与空气组成的燃料电池中,电解质溶液是30%的KOH溶液,该电池放电时正极的电极反应式为O2+2H2O+4e-═4OH-;
(5)若使用Y-空气燃料电池精炼铜,当得到精铜80g时,燃料电池中转移的电子数为2.5NA.
| 元素 | 有 关 信 息 |
| A | 元素主要化合价为-2,原子半径为0.074nm |
| B | 所在主族序数与所在周期序数之差为4 |
| C | 原子半径为0.102nm,其单质为黄色晶体,可在A的单质中燃烧 |
| D | 最高价氧化物的水化物能按1:1电离出电子数相等的阴、阳离子 |
| E | 原子半径为0.075nm,最高价氧化物的水化物可与其氢化物形成一种盐X |
 ;
;(2)写出B单质与水反应的离子方程式Cl2+H2O=Cl-+H++HClO;
(3)元素A和D形成的某种化合物可作为呼吸面具中氧气的来源,写出得到氧气反应的主要化学方程式2Na2O2+2CO2═2Na2CO3+O2;
(4)已知E元素的某种氢化物Y与A2的摩尔质量相同,Y与空气组成的燃料电池中,电解质溶液是30%的KOH溶液,该电池放电时正极的电极反应式为O2+2H2O+4e-═4OH-;
(5)若使用Y-空气燃料电池精炼铜,当得到精铜80g时,燃料电池中转移的电子数为2.5NA.
18.下列反应最终无沉淀产生的是( )
①过量的CO2通入Na2SiO3溶液中 ②向氢氧化铝溶液中滴加氢氧化钠溶液至过量
③少量的SO2通入BaCl2溶液中 ④向MgCl2溶液中滴加NaOH溶液至过量.
①过量的CO2通入Na2SiO3溶液中 ②向氢氧化铝溶液中滴加氢氧化钠溶液至过量
③少量的SO2通入BaCl2溶液中 ④向MgCl2溶液中滴加NaOH溶液至过量.
| A. | ①② | B. | ②③ | C. | ②④ | D. | ①④ |
15.Ⅰ.碱性锌锰干电池是最常见的化学电源之一,已知其电池总反应:
Zn+2MnO2+2H2O=2MnOOH+Zn(OH)2,则负极发生反应的物质为Zn+2OHˉ-2eˉ=Zn(OH)2;发生在正极的电极反应为MnO2+H2O+e-=MnO(OH)+OH-.
Ⅱ.回收的废旧锌锰干电池经过处理后得到锰粉(含MnO2、MnOOH、Fe和炭黑等),由锰粉制取MnO2的步骤如图所示:
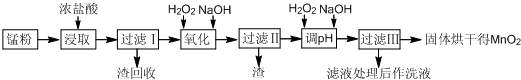
根据如图所示步骤并参考表格数据回答问题:
(1)在加热条件下用浓盐酸浸取锰粉,所得溶液中含有Mn2+、Fe2+等.加热的作用是加快反应速率.
(2)锰粉经浓盐酸浸取,过滤I除去不溶杂质后,向滤液中加入适量H2O2溶液,其作用是将Fe2+转化为Fe3+.
(3)将过滤I所得滤液经H2O2氧化后,再加入NaOH溶液调节pH的范围是:3.7<pH<8.3,其目的是使Fe3+完全沉淀,并防止Mn2+转化为Mn(OH)2沉淀.
(4)过滤Ⅱ所得滤液加入足量H2O2溶液并加入NaOH溶液调节pH约为9,使Mn2+氧化得到MnO2,反应的离子方程式为Mn2++H2O2+2OH-=MnO2↓+2H2O.
(5)实验室进行过滤操作时,需要用到的玻璃仪器有漏斗、烧杯、玻璃棒.
Zn+2MnO2+2H2O=2MnOOH+Zn(OH)2,则负极发生反应的物质为Zn+2OHˉ-2eˉ=Zn(OH)2;发生在正极的电极反应为MnO2+H2O+e-=MnO(OH)+OH-.
Ⅱ.回收的废旧锌锰干电池经过处理后得到锰粉(含MnO2、MnOOH、Fe和炭黑等),由锰粉制取MnO2的步骤如图所示:

| 开始沉淀 | 沉淀完全 | |
| Fe(OH)3 | 2.7 | 3.7 |
| Fe(OH)2 | 7.6 | 9.6 |
| Mn(OH)2 | 8.3 | 9.8 |
(1)在加热条件下用浓盐酸浸取锰粉,所得溶液中含有Mn2+、Fe2+等.加热的作用是加快反应速率.
(2)锰粉经浓盐酸浸取,过滤I除去不溶杂质后,向滤液中加入适量H2O2溶液,其作用是将Fe2+转化为Fe3+.
(3)将过滤I所得滤液经H2O2氧化后,再加入NaOH溶液调节pH的范围是:3.7<pH<8.3,其目的是使Fe3+完全沉淀,并防止Mn2+转化为Mn(OH)2沉淀.
(4)过滤Ⅱ所得滤液加入足量H2O2溶液并加入NaOH溶液调节pH约为9,使Mn2+氧化得到MnO2,反应的离子方程式为Mn2++H2O2+2OH-=MnO2↓+2H2O.
(5)实验室进行过滤操作时,需要用到的玻璃仪器有漏斗、烧杯、玻璃棒.
16.标准状况下质量为4g H2的体积约为( )
| A. | 11.2 L | B. | 22.4 L | C. | 33.6 L | D. | 44.8 L |