题目内容
常温下,下列各溶液的叙述中正确的是
| A.NaHSO3与Na2SO3混合溶液中:3c(Na+) = c(HSO3-) + c(SO32-) |
| B.0.1mol·L-1的醋酸钠溶液20 mL与0.1mol·L-1盐酸10 mL混合后溶液显酸性 c (CH3COO-)>c (Cl-)>c (CH3COOH)>c (H+) |
| C.等物质的量浓度等体积的NH4HSO4和NaOH溶液混合: c(Na+)=c(SO42-)>c(NH4+)>c(H+)>c(OH-) |
| D.向1.00 L 0.3mol·L-1NaOH溶液中缓慢通入0.2molCO2气体,溶液中: |
BC
解析试题分析:A、NaHSO3与Na2SO3物质的量之比不确定,则c(Na+)与c(HSO3-) + c(SO32-)的关系无法确定,错误;B、0.1mol·L-1的醋酸钠溶液20 mL与0.1mol·L-1盐酸10 mL混合后生成等量的CH3COOH、NaCl和CH3COONa,则:c (CH3COO-)>c (Cl-)>c (CH3COOH)>c (H+),正确;C、等物质的量浓度等体积的NH4HSO4和NaOH溶液混合,生成等量的(NH4)2SO4和Na2SO4,因为NH4+发生水解反应使溶液呈酸性,则c(Na+)=c(SO42-)>c(NH4+)>c(H+)>c(OH-),正确;D、向1.00 L 0.3mol·L-1NaOH溶液中缓慢通入0.2molCO2气体,生成等量的Na2CO3和NaHCO3,因为CO32?的水解程度大,则c(Na+) > c(HCO3-) >c(CO32-)> c(OH-) > c(H+),错误。
考点:本题考查离子浓度比较。

练习册系列答案
 优学名师名题系列答案
优学名师名题系列答案
相关题目
下列事实中,能说明HNO2是弱电解质的是
| A.用HNO2溶液做导电性实验,灯泡较暗 |
| B.HNO2是共价化合物 |
| C.HNO2溶液不与NaCl反应 |
| D.室温下,0.1mol·L-1 HNO2溶液的pH为2.15 |
25℃时,下列溶液中水的电离程度最小的是
| A.0.01 mol/L盐酸 | B.0.01 mol/L Na2CO3溶液 |
| C.pH =" 4" NaHSO3溶液 | D.pH =11氨水 |
常温下,含a mol CH3COOH和b mol NaOH的两溶液混合后,下列推论不正确的是
| A.若a≤b,混合液的pH一定小于7 |
| B.若a=2b,则混合液中c(CH3COO-)>c(Na+)>c(CH3COOH)>c(H+)>c(OH-) |
| C.混合液中,c(Na+)+c(H+)=c(OH-)+c(CH3COO-)一定成立 |
| D.当混合液的pH>7时,c(Na+)>c(CH3COO-)>c(OH-)>c(H+)一定成立 |
物质的量浓度相同的下列物质中,含粒子种类最多的是
| A.CaCl2 | B.CH3COONa | C.K2S | D.NH3 |
下列说法正确的是
| A.镀锌铁板是利用了牺牲阳极的阴极保护法来达到防止腐蚀的目的 |
| B.在滴有酚酞的Na2CO3溶液中,加入BaCl2溶液后红色褪去,说明BaCl2溶液显酸性 |
| C.合成氨反应需使用催化剂,说明催化剂可以促进该平衡向生成氨的方向移动 |
D.汽车尾气的净化反应2NO+2CO 2CO2+N2△H<0,则该反应一定能自发进行 2CO2+N2△H<0,则该反应一定能自发进行 |
下列说正确的是
【已知:HClO的Ka=3.0×l0-8;H2CO3的Ka1= 4.3×l0-7,Ka2=5.6×l0-11;Ksp(BaSO4)=" 1.1" ×10-10;Ksp(BaCO3)=" 5.1" ×10-9】
| A.相同条件下,pH相同的NaClO和Na2CO3溶液,物质的量浓度前者小于后者 |
| B.常温下,将CH3COONa溶液和稀盐酸混合至溶液pH=7时: c(Na+)>c(CH3COO-)>c(Cl-) >c(CH3COOH)>c(H+)=c(OH-) |
| C.向饱和Na2CO3溶液中通入足量的CO2,溶液变浑浊,由此证明了NaHCO3溶解度比Na2CO3小 |
| D.氯碱工业使用的食盐水需先除去其中的Ca2+、Mg2+、SO42-等杂质。除杂时,粗盐水中可先加入过量的BaCl2溶液,至沉淀不再产生后,再加入过量的Na2CO3和NaOH,充分反应后滤去沉淀,所得滤液中仍含有一定量的SO42- |
下列关于0.10 mol·L-1 NaHCO3溶液的说法正确的是
| A.溶质的电离方程式为NaHCO3=Na++ H++ CO32- |
| B.25 ℃时,加水稀释后,n(H+)与n(OH-)的乘积变大 |
| C.离子浓度关系:c(Na+)+c(H+)=c(OH-)+c(HCO3-)+c(CO32-) |
| D.温度升高,c(HCO3-)增大 |
下列叙述正确的是 ( )
| A.将过量CO2气体通入水玻璃中可制得硅酸和纯碱 |
B.标准状况下,2.24L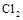 与过量稀NaOH溶液反应,转移电子0.1mol 与过量稀NaOH溶液反应,转移电子0.1mol |
| C.1L2mol·L-1明矾经水解可得到氢氧化铝胶体粒子数目为2×6.02×1023 |
| D.漂白粉溶于水能导电,故漂白粉是电解质 |