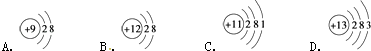��Ŀ����
����Ŀ���������߷ֱ��ʾԪ�ص�ij��������˵�����Ĺ�ϵ��ZΪ�˵������YΪԪ�ص��й����ʣ���
��1�����������Ԫ���й�������������ߵı��������Ӧ�����У�a.��A��Ԫ�ص����������� ��
b.��������Ԫ�ص�����ϼ� ��
c.������������Na+��Mg2+��Al3+��P3����S2����Cl�������Ӱ뾶 ��
d.�ڶ���������Ԫ����ԭ����������ԭ�Ӱ뾶�ı仯 ��
��2�������������ʣ��� ![]() C����
C���� ![]() K����
K���� ![]() Ca����
Ca���� ![]() C����
C���� ![]() N����
N���� ![]() Ar�����У� a.��Ϊͬλ�ص��� ��
Ar�����У� a.��Ϊͬλ�ص��� ��
b.��������ȣ������ܻ���ͬλ�ص��� ��
c.��������ȣ�������������ȵ��� ��
���𰸡�
��1��B��C��E��G
��2���٢ܣ��ۢޣ��ںۣ͢��ܺ͢�
���������⣺��1����a.ͬһ����Ԫ�ؼ۵�������ȣ���ԭ�������أ���IIA��Ԫ�ؼ۵���������2�����Դ��ǣ�B��b.��������Ԫ�ص���������ϼ�����ԭ���������������ϡ������Ļ��ϼ�Ϊ0�����Դ��ǣ�C��c.���Ӳ�Խ�࣬���Ӱ뾶Խ���Ӳ�ṹ��ͬ�����������Ӱ뾶����ԭ�������������С��Na+��Mg2+��Al3+�����Ӱ뾶���μ�С��P3����S2����Cl�������Ӱ뾶���μ�С�������Ӱ뾶���������Ӱ뾶������E���ϣ����Դ��ǣ�E��d.���Ӳ�Խ�࣬�뾶Խ�������ڵ�ԭ�Ӱ뾶���ڵڶ����ڣ�ͬ����ԭ�Ӱ뾶����ԭ�������������С������G���ϣ�
���Դ��ǣ�G����2���� ![]() C��������Ϊ6��������Ϊ12��������=12��6=6��
C��������Ϊ6��������Ϊ12��������=12��6=6��
�� ![]() K��������Ϊ19��������Ϊ39��������Ϊ39��19=20��
K��������Ϊ19��������Ϊ39��������Ϊ39��19=20��
�� ![]() Ca��������Ϊ20��������Ϊ40��������Ϊ40��20=20��
Ca��������Ϊ20��������Ϊ40��������Ϊ40��20=20��
�� ![]() C��������Ϊ6��������Ϊ13��������Ϊ13��6=7��
C��������Ϊ6��������Ϊ13��������Ϊ13��6=7��
�� ![]() N��������Ϊ7��������Ϊ14��������Ϊ14��7=7��
N��������Ϊ7��������Ϊ14��������Ϊ14��7=7��
�� ![]() Ar��������Ϊ18��������Ϊ40��������Ϊ40��18=22�� a.��Ϊͬλ�ص��Ǣ٢ܣ����Դ��ǣ��٢ܣ�b.��������ȣ������ܻ���ͬλ�ص��Ǣۢޣ����Դ��ǣ��ۢޣ�c.��������ȣ�������������ȵ��Ǣںۣ͢��ܺ͢ݣ����Դ��ǣ��ںۣ͢��ܺ͢ݣ�
Ar��������Ϊ18��������Ϊ40��������Ϊ40��18=22�� a.��Ϊͬλ�ص��Ǣ٢ܣ����Դ��ǣ��٢ܣ�b.��������ȣ������ܻ���ͬλ�ص��Ǣۢޣ����Դ��ǣ��ۢޣ�c.��������ȣ�������������ȵ��Ǣںۣ͢��ܺ͢ݣ����Դ��ǣ��ںۣ͢��ܺ͢ݣ�

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�����Ŀ��X��Y��Z��W��Q��R��Ϊǰ������Ԫ�أ���ԭ���������������������Ϣ���±���ʾ��
XԪ�صĻ�̬ԭ���е��ӷֲ���������ͬ���ܼ��У���ÿ���ܼ��еĵ���������ͬ |
YԪ�ص���̬�⻯����������������Ӧ��ˮ�����ܷ������Ϸ�Ӧ |
ZԪ�ص����������������������� |
Wԭ�ӵĵ�һ�����������ֱܷ�Ϊ��I1=578KJmol��1 I2=1817KJmol��1 I3=2745KJmol��1I4=11575KJmol��1 I5=14830KJmol��1 I6=18376KJmol��1 |
QΪǰ�������е縺����С��Ԫ�� |
Ԫ��Rλ�����ڱ��ĵ�10�� |
�ش��������⣺
��1��YԪ�صĻ�̬ԭ����δ�ɶԵ�����Ϊ��X��Y��Z����Ԫ��ԭ�ӵĵ�һ��������С�����˳��Ϊ����Ԫ�ط��ű�ʾ����
��2��W���Ȼ�����۵��Q���Ȼ�����۵�����ߡ��͡�����������
��3������֤ʵԪ��W�ĵ�����ǿ������Һ��Ӧ��[W��OH��4]�����ɣ���[W��OH��4]���д��ڣ�����ĸ�� �� a�����Թ��ۼ� b���Ǽ��Թ��ۼ� c����λ�� d�����
��4������X��R��þ����Ԫ�ص�ij�־�����г����ԣ���ṹ��ͼ��ʾ����þ���Ļ�ѧʽΪ��������ÿ��þԭ����Χ���������Rԭ��������