��Ŀ����
����Ŀ���ش��������⣺
��1����ͼΪ�������ӵĽṹʾ��ͼ�����������գ�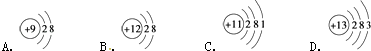
���������ӽṹ��������������ĸ��ţ���ͬ����A���ӵİ뾶B���ӵİ뾶�����������������=������
��2���л���M����̫������տ�ת����N��ת���������£� 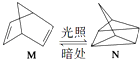 ��H=+88.6kJmol��1��M��N��ȣ����ȶ����� ��
��H=+88.6kJmol��1��M��N��ȣ����ȶ����� ��
��3����������������Ӧ����1molˮ�����ų�����241.8kJ��д���÷�Ӧ���Ȼ�ѧ����ʽΪ�� ��
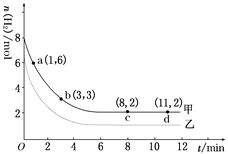
��4��һ���¶�����ij���������з�����Ӧ��2A��g��+3B��g��2C��g������ʼʱ��A��Ũ��Ϊ2molL��1 �� B��Ũ��Ϊ4molL��1 �� 2min��A��Ũ�ȼ���0.8molL��1 �� ���v��B��= �� v��C��= ��
����2minĩ��C��Ũ���� �� B��Ũ���� ��
���𰸡�
��1��B����
��2��M
��3��H2��g��+ ![]() O2��g��=H2O��g����H=��241.8kJ/mol
O2��g��=H2O��g����H=��241.8kJ/mol
��4��0.6 mol?L ��1?min��1��0.4 mol?L ��1?min��1��0.8 mol/L��2.8 mol/L
���������⣺��1����Ϊ�����ӵĺ������������������������BΪ�����ӣ�A��B����Ϊ��ͬ��Ԫ�ص��������Ӳ���ͬ�����˵����Խ�뾶ԽС����B�İ뾶С��A�����Դ��ǣ�B��������2��ת�����������ȷ�Ӧ����M����������N�������ʵ�����Խ������Խ�ȶ�����˵��M�ȶ������Դ��ǣ�M����3��������������Ӧ����1molˮ��������241.8kJ���÷�Ӧ���Ȼ�ѧ����ʽΪ��H2��g��+ ![]() O2��g��=H2O��g����H=��241.8kJ/mol�� ���Դ��ǣ�H2��g��+
O2��g��=H2O��g����H=��241.8kJ/mol�� ���Դ��ǣ�H2��g��+ ![]() O2��g��=H2O��g����H=��241.8kJ/mol����4����v��A��=
O2��g��=H2O��g����H=��241.8kJ/mol����4����v��A��= ![]() =0.4molL ��1min��1 �� ��������֮�ȵ��ڻ�ѧ������֮�ȿɵã�v��B��=
=0.4molL ��1min��1 �� ��������֮�ȵ��ڻ�ѧ������֮�ȿɵã�v��B��= ![]() v��A��=
v��A��= ![]() ��0.4molL ��1min��1=0.6 molL ��1min��1��
��0.4molL ��1min��1=0.6 molL ��1min��1��
v��C��=v��A���� ![]() =0.4 molL ��1min��1��
=0.4 molL ��1min��1��
���Դ��ǣ�0.6 molL ��1min��1��0.4 molL ��1min��1��
�ڡ�c��C��=0.4 molL ��1min��1��2min=0.8mol/L����2minĩC��Ũ��Ϊ0+0.8mol/L=0.8mol/L����c��B��=2min��0.6 molL ��1min��1=1.2mol/L����2minĩB��Ũ��Ϊ4mol/L��1.2mol/L=2.8mol/L����c��C��=0.8 mol/L��c��B��=2.8 mol/L��
���Դ��ǣ�0.8 mol/L��2.8 mol/L��
�����㾫����������Ҫ�����˷�Ӧ�Ⱥ��ʱ�ͻ�ѧƽ��ļ�������֪ʶ�㣬��Ҫ�����ڻ�ѧ��Ӧ�зų������յ�������ͨ���з�Ӧ�ȣ���Ӧ��ת����=ת��Ũ�ȡ���ʼŨ�ȡ�100%=ת�����ʵ�������ʼ���ʵ�����100%����Ʒ�IJ���=ʵ�����ɲ�������ʵ����������Ͽɵõ���������ʵ�����100%������ȷ�����⣮

 С�����ϵ�д�
С�����ϵ�д�����Ŀ��X��Y��Z��T��W����Ԫ�ص����ʻ�ԭ�ӽṹ���±���
Ԫ�� | Ԫ�����ʻ�ԭ�ӽṹ |
X | ԭ�ӵ������������Ǵ�����������2�� |
Y | �����µ���Ϊ˫ԭ�ӷ��ӣ����⻯��ˮ��Һ�ʼ��� |
Z | ��̬ԭ�����������Ų�ʽΪ��n+1��sn��n+1��pn+2 |
T | ��Zͬ���ڣ�Ԫ�������+7�� |
W | ԭ������ΪY��TԪ��֮�ͣ�������к��и�Ԫ�� |
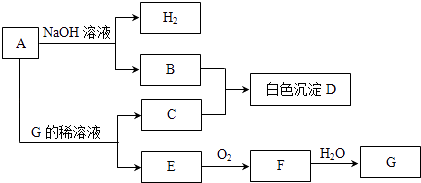
��1��Ԫ��X��һ��ͬλ�ؿɲⶨ�������������ͬλ�صķ�������WԪ�ػ�̬ԭ�ӵ����Ų�ʽΪ ��
��2��Ԫ��Z��Ԫ��T��ȣ��ǽ����Խ�ǿ��������Ԫ�ط��ű�ʾ�������б�������֤����һ��ʵ���� �� A��������Z�ĵ��ʺ�T�ĵ���״̬��ͬ
B��T���⻯���Z���⻯���ȶ�
C��һ��������Z��T�ĵ��ʶ���������������Һ��Ӧ
D��T�ĵ縺�Ա�Z��
��3�������ܼ�XZ2�ķ����У����еĦҼ���м�������Ϊ �� �����γɵľ�������Ϊ�� Y�ij����⻯����Һ������Ҫԭ����
��4������Ȼ�糣����XԪ�غ�����ĸ��κ�����T���⻯����Һ��Ӧʱ��ÿ����4.4g ���壨�����������ܽ⣩����a kJ����÷�Ӧ���Ȼ�ѧ����ʽΪ �� ��������Ӧ���������ݳ���ȡ����������Һ������pH����������ε���̼������Һ�����pH�仯������ͼ��ʾ
�������ӷ���ʽ��ʾBC�Ρ�CD�η����ķ�Ӧ��
BC����
CD�� ��