题目内容
【题目】用硫酸分解磷尾矿[主要成份为Ca5(PO4)3F]可制得中强酸磷酸H3PO4。请回答:
(1)Na2HPO4溶液呈碱性,则在该溶液中c(H2PO4-)_____c(PO43-)(填“>”、“<”、“=”),向Na2HPO4溶液中加入足量的CaCl2溶液,溶液显酸性,溶液显酸性的原因是(从电离平衡移动角度分析):________________________。
(2)Ca5(PO4)3F(s) +OH-(aq)![]() Ca5(PO4)3(OH) (s)+F-,该温度下,溶液中c(F-)随溶液的pH和温度(T)的变化曲线如图所示。
Ca5(PO4)3(OH) (s)+F-,该温度下,溶液中c(F-)随溶液的pH和温度(T)的变化曲线如图所示。

则:适当______温度有利于磷尾矿转化为羟基磷灰石(填“升高”、“降低”);pH1___pH2(填“>”、“<”、“=”);A、B两点的溶液中F—的速率v(A)____v(B)(填“>”、 “<”、“=”);
(3)已知:25℃时,H3PO4的电离平衡常数:K1=7.52×10-3;K2=6.23×10-8;K3=6.23×10-13,则:H3PO4(aq)+OH-(aq)![]() H2PO4-(aq)+H2O (l)的平衡常数K=____________。
H2PO4-(aq)+H2O (l)的平衡常数K=____________。
【答案】 > Na2HPO4溶液中存在电离平衡HPO42-![]() H++PO43-,加入CaCl2溶液后的Ca2+与PO43-结合生成Ca3(PO4)2沉淀,促使Na2HPO4电离平衡向右移动,H+浓度增大溶液显酸性 升高 < > 7.52×1011L/mol
H++PO43-,加入CaCl2溶液后的Ca2+与PO43-结合生成Ca3(PO4)2沉淀,促使Na2HPO4电离平衡向右移动,H+浓度增大溶液显酸性 升高 < > 7.52×1011L/mol
【解析】(1)Na2HPO4溶液呈碱性,说明HPO42-电离程度小于水解程度,所以c(H2PO4-) >c(PO43-);向Na2HPO4溶液中加入足量的CaCl2溶液,溶液显酸性,Na2HPO4溶液中存在电离平衡HPO42-![]() H++PO43-,加入CaCl2溶液后的Ca2+与PO43-结合生成Ca3(PO4)2沉淀,促使Na2HPO4电离平衡向右移动,H+浓度增大溶液显酸性;(2)根据溶液中c(F-)随溶液的pH和温度(T)的变化曲线可知,升高温度c(F-)增大,反应Ca5(PO4)3F(s) +OH-(aq)
H++PO43-,加入CaCl2溶液后的Ca2+与PO43-结合生成Ca3(PO4)2沉淀,促使Na2HPO4电离平衡向右移动,H+浓度增大溶液显酸性;(2)根据溶液中c(F-)随溶液的pH和温度(T)的变化曲线可知,升高温度c(F-)增大,反应Ca5(PO4)3F(s) +OH-(aq)![]() Ca5(PO4)3(OH) (s)+F-(aq)正向移动,故适当升高温度有利于磷尾矿转化为羟基磷灰石;相同温度下,pH增大,c(OH-)增大,平衡Ca5(PO4)3F(s) +OH-(aq)
Ca5(PO4)3(OH) (s)+F-(aq)正向移动,故适当升高温度有利于磷尾矿转化为羟基磷灰石;相同温度下,pH增大,c(OH-)增大,平衡Ca5(PO4)3F(s) +OH-(aq)![]() Ca5(PO4)3(OH) (s)+F-(aq)正向移动,c(F-)越大,故pH1<pH2;温度越高,化学反应速率越大,A、B两点的温度A大于B,溶液中F—的速率v(A) >v(B);(3)H3PO4(aq)+OH-(aq)
Ca5(PO4)3(OH) (s)+F-(aq)正向移动,c(F-)越大,故pH1<pH2;温度越高,化学反应速率越大,A、B两点的温度A大于B,溶液中F—的速率v(A) >v(B);(3)H3PO4(aq)+OH-(aq)![]() H2PO4-(aq)+H2O (l)的平衡常数K=
H2PO4-(aq)+H2O (l)的平衡常数K=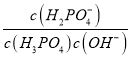 =
= =
=![]() =
=![]() =7.52×1011L/mol。
=7.52×1011L/mol。

 名校课堂系列答案
名校课堂系列答案