题目内容
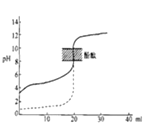
【题目】氢氧化钙是一种微溶于水的碱。如图是Ca(OH)2在温度分别为 T1、T2 时的两种沉淀溶解平衡曲线(浓度单位为 mol·L -1,与曲线Ⅰ对应的 Ksp=4×10-6,![]() ≈1.6)。下列说法中正确的是
≈1.6)。下列说法中正确的是
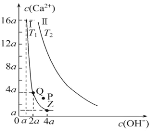
A.Q 点的溶液中c(OH-)约为0.0125 mol·L -1
B.在温度为T1时,P点分散系中分散质粒子直径<1 nm
C.温度:T1<T2
D.加水稀释时溶液碱性减弱,Z 点溶液可转化为Q点溶液
【答案】A
【解析】
A.Q点,Ksp=4a(2a)2=4×10-6,a=![]() mol/L,则溶液中c(OH-)=2a= 0.0125 mol·L -1,A正确;
mol/L,则溶液中c(OH-)=2a= 0.0125 mol·L -1,A正确;
B.在温度为T1时,P点离子浓度大于饱和溶液,所以应为悬浊液,分散系中分散质粒子直径>1 nm,B不正确;
C.Ca(OH)2的溶解度随温度的升高而减小,c(OH-)相同时,Ⅱ中溶解度大,则表明温度低,所以温度:T1>T2,C不正确;
D.加水稀释时溶液若c(OH-)减小,则c(Ca2+)也减小,所以Z 点溶液不可能转化为Q点溶液,D不正确;
故选A。

练习册系列答案
 天天向上口算本系列答案
天天向上口算本系列答案
相关题目