题目内容
(1)已知:
①Fe(s)+ O2(g)=FeO(s) ΔH=-272.0 kJ·mol-1
O2(g)=FeO(s) ΔH=-272.0 kJ·mol-1
②2Al(s)+ O2(g)=Al2O3(s) ΔH=-1675.7 kJ·mol-1
O2(g)=Al2O3(s) ΔH=-1675.7 kJ·mol-1
Al和FeO发生铝热反应的热化学方程式是____________________________________

(2)某可逆反应在不同条件下的反应历程分别为A、B(如上图所示)。
①根据图判断该反应达到平衡后,其他条件不变,升高温度,反应物的转化率________(填“增大”“减小”或“不变”);
②其中B历程表明此反应采用的条件为________(选填序号)。
A.升高温度 B.增大反应物的浓度 C.降低温度 D.使用催化剂
(3)1000 ℃时,硫酸钠与氢气发生下列反应:Na2SO4(s)+4H2(g) Na2S(s)+4H2O(g)
Na2S(s)+4H2O(g)
该反应的平衡常数表达式为________________________________;
已知K1000 ℃<K1200 ℃,若降低体系温度,混合气体的平均相对分子质量将会________(填“增大”“减小”或“不变”)。
(4)常温下,如果取0.1 mol·L-1 HA溶液与0.1 mol·L-1 NaOH溶液等体积混合(混合后溶液体积的变化忽略不计),测得混合液的pH=8。
①混合液中由水电离出的OH-浓度与0.1 mol·L-1 NaOH溶液中由水电离出的OH-浓度之比为________;
②已知NH4A溶液为中性,又知将HA溶液加到Na2CO3溶液中有气体放出,试推断(NH4)2CO3溶液的pH________7(填“<”“>”或“=”);相同温度下,等物质的量浓度的下列四种盐溶液按pH由大到小的排列顺序为(填序号)________。
a.NH4HCO3 b.NH4A c.(NH4)2CO3 d.NH4Cl
①Fe(s)+
 O2(g)=FeO(s) ΔH=-272.0 kJ·mol-1
O2(g)=FeO(s) ΔH=-272.0 kJ·mol-1②2Al(s)+
 O2(g)=Al2O3(s) ΔH=-1675.7 kJ·mol-1
O2(g)=Al2O3(s) ΔH=-1675.7 kJ·mol-1Al和FeO发生铝热反应的热化学方程式是____________________________________

(2)某可逆反应在不同条件下的反应历程分别为A、B(如上图所示)。
①根据图判断该反应达到平衡后,其他条件不变,升高温度,反应物的转化率________(填“增大”“减小”或“不变”);
②其中B历程表明此反应采用的条件为________(选填序号)。
A.升高温度 B.增大反应物的浓度 C.降低温度 D.使用催化剂
(3)1000 ℃时,硫酸钠与氢气发生下列反应:Na2SO4(s)+4H2(g)
 Na2S(s)+4H2O(g)
Na2S(s)+4H2O(g)该反应的平衡常数表达式为________________________________;
已知K1000 ℃<K1200 ℃,若降低体系温度,混合气体的平均相对分子质量将会________(填“增大”“减小”或“不变”)。
(4)常温下,如果取0.1 mol·L-1 HA溶液与0.1 mol·L-1 NaOH溶液等体积混合(混合后溶液体积的变化忽略不计),测得混合液的pH=8。
①混合液中由水电离出的OH-浓度与0.1 mol·L-1 NaOH溶液中由水电离出的OH-浓度之比为________;
②已知NH4A溶液为中性,又知将HA溶液加到Na2CO3溶液中有气体放出,试推断(NH4)2CO3溶液的pH________7(填“<”“>”或“=”);相同温度下,等物质的量浓度的下列四种盐溶液按pH由大到小的排列顺序为(填序号)________。
a.NH4HCO3 b.NH4A c.(NH4)2CO3 d.NH4Cl
(1)3FeO(s)+2Al(s)=Al2O3(s)+3Fe(s) ΔH=-859.7 kJ/mol
(2)①增大 ②D
(3)K=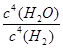 减小
减小
(4)①107 ②> c>a>b>d
(2)①增大 ②D
(3)K=
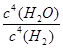 减小
减小(4)①107 ②> c>a>b>d
(1)方程式②-①×3可得:3FeO(s)+2Al(s)=Al2O3(s)+3Fe(s),该反应的ΔH=-1 675.7 kJ/mol+3×272.0 kJ/mol=-859.7 kJ/mol;(2)催化剂可以降低反应的活化能;(3)固体或纯液体的浓度不列入平衡常数表达式中;平衡常数越大,则反应进行的越完全,该反应为气体分子数不变但质量增加的反应,降低体系温度,平衡常数减小,说明平衡向逆反应方向移动,气体分子数不变但质量减小,故混合气体的平均相对分子质量会减小;(4)①混合液中c(H+)=10-8 mol/L,c(OH-)=10-6 mol/L,其中OH-全部由水电离;0.1 mol/L NaOH溶液中c(OH-)=10-1 mol/L,c(H+)=10-13 mol/L,其中水电离出来的OH-浓度等于溶液中H+浓度,则混合液中由水电离出的OH-浓度与0.1 mol·L-1 NaOH溶液中由水电离出的OH-浓度之比为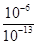 =107;②NH4A为中性,可知A-与NH4+水解程度相等;将HA溶液加到Na2CO3溶液中有气体放出,可知H2CO3酸性比HA弱,则HCO3—水解程度比A-大,而CO32—水解程度比HCO3—大,故NH4HCO3溶液、(NH4)2CO3溶液均显碱性且碱性NH4HCO3<(NH4)2CO3;NH4Cl为强酸弱碱盐,显酸性
=107;②NH4A为中性,可知A-与NH4+水解程度相等;将HA溶液加到Na2CO3溶液中有气体放出,可知H2CO3酸性比HA弱,则HCO3—水解程度比A-大,而CO32—水解程度比HCO3—大,故NH4HCO3溶液、(NH4)2CO3溶液均显碱性且碱性NH4HCO3<(NH4)2CO3;NH4Cl为强酸弱碱盐,显酸性
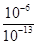 =107;②NH4A为中性,可知A-与NH4+水解程度相等;将HA溶液加到Na2CO3溶液中有气体放出,可知H2CO3酸性比HA弱,则HCO3—水解程度比A-大,而CO32—水解程度比HCO3—大,故NH4HCO3溶液、(NH4)2CO3溶液均显碱性且碱性NH4HCO3<(NH4)2CO3;NH4Cl为强酸弱碱盐,显酸性
=107;②NH4A为中性,可知A-与NH4+水解程度相等;将HA溶液加到Na2CO3溶液中有气体放出,可知H2CO3酸性比HA弱,则HCO3—水解程度比A-大,而CO32—水解程度比HCO3—大,故NH4HCO3溶液、(NH4)2CO3溶液均显碱性且碱性NH4HCO3<(NH4)2CO3;NH4Cl为强酸弱碱盐,显酸性
练习册系列答案
相关题目
 CO(g)+H2(g);②C(s)、CO(g)和H2(g)完全燃烧的热化学方程式分别为:
CO(g)+H2(g);②C(s)、CO(g)和H2(g)完全燃烧的热化学方程式分别为:

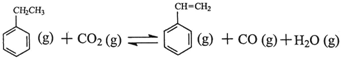 △H
△H △H1=+117.6kJ·mol-1
△H1=+117.6kJ·mol-1 CO (g)+H2O (g) △H2=+41.2kJ·mol-1
CO (g)+H2O (g) △H2=+41.2kJ·mol-1 。
。 ,则反应达到平衡时苯乙烯的浓度为 , (均用含
,则反应达到平衡时苯乙烯的浓度为 , (均用含 CO2(g) + 3H2(g) ;△H>0
CO2(g) + 3H2(g) ;△H>0

 2NH3(g)的特点,在给出的坐标图2中,画出其在1 MPa和10 MPa条件下H2的转化率随温度变化的趋势曲线示意图,并标明各条曲线的压强。
2NH3(g)的特点,在给出的坐标图2中,画出其在1 MPa和10 MPa条件下H2的转化率随温度变化的趋势曲线示意图,并标明各条曲线的压强。
 2H2↑+O2↑
2H2↑+O2↑ 2H2↑+O2↑
2H2↑+O2↑ 2H2↑+O2↑
2H2↑+O2↑ CO+3H2
CO+3H2 CH3OH(g)+H2O(g) ΔH="-49.0" kJ/mol,测得CO2和CH3OH(g)的浓度随时间变化如图所示。
CH3OH(g)+H2O(g) ΔH="-49.0" kJ/mol,测得CO2和CH3OH(g)的浓度随时间变化如图所示。
 CH3OH(g)的平衡常数:
CH3OH(g)的平衡常数:


 H2(g)+
H2(g)+