题目内容
【题目】
(1)含有11.2 g KOH的稀溶液与1 L 0.1 mol·L-1的H2SO4溶液反应,放出11.46 kJ的热量,表示该反应中和热的热化学方程式为___________________________,
表示该反应中和热的离子方程式为_________________________________。
(2)已知在常温常压下:
①2CH3OH(l)+3O2(g) ===2CO2(g)+4H2O(g) ΔH=-1275.6 kJ·mol-1
②H2O(l)===H2O(g) ΔH=+44.0 kJ·mol-1
写出表示甲醇燃烧热的热化学方程式__________________________________。
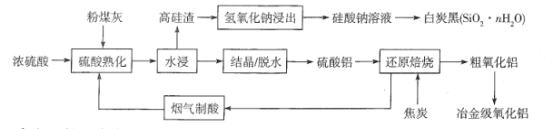
(3)FeSO4可转化为FeCO3,FeCO3在空气中加热反应可制得铁系氧化物材料。
已知25 ℃,101 kPa时:
4Fe(s)+3O2(g)===2Fe2O3(s) ΔH=-1 648 kJ/mol
C(s)+O2(g)===CO2(g) ΔH=-393 kJ/mol
2Fe(s)+2C(s)+3O2(g)===2FeCO3(s) ΔH=-1 480 kJ/mol
FeCO3在空气中加热反应生成Fe2O3的热化学方程式是
_________________________________________________________________。
(4)在25 ℃、101 kPa下,一定质量的无水乙醇完全燃烧时放出热量Q kJ,其燃烧生成的CO2用过量饱和石灰水吸收可得100 g CaCO3沉淀,则乙醇燃烧的热化学方程式为______________________________________________。
(5)已知反应2HI(g)===H2(g)+I2(g)的ΔH=+11 kJ·mol-1,1 mol H2(g)、1 mol I2(g)分子中化学键断裂时分别需要吸收436 kJ、151 kJ的能量,则1 mol HI(g)分子中化学键断裂时需吸收的能量为________________kJ。
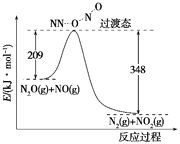
(6)由N2O和NO反应生成N2和NO2的能量变化如图所示,若生成1 mol N2,其ΔH=________kJ·mol-1。
【答案】 KOH(aq)+![]() H2SO4(aq)
H2SO4(aq)![]()
![]() K2SO4(aq)+H2O(l) ΔH=-57.3 kJ·mol-1 H+(aq)+OH-(aq)===H2O(l) ΔH=-57.3 kJ·mol-1 CH3OH(l)+
K2SO4(aq)+H2O(l) ΔH=-57.3 kJ·mol-1 H+(aq)+OH-(aq)===H2O(l) ΔH=-57.3 kJ·mol-1 CH3OH(l)+![]() O2(g)===CO2(g)+2H2O(l) ΔH=-725.8 kJ·mol-1 4FeCO3(s)+O2(g)===2Fe2O3(s)+4CO2(g) ΔH=-260 kJ/mol C2H5OH(l)+3O2(g)===2CO2(g)+3H2O(l) ΔH=-2Q kJ·mol-1 299 -139
O2(g)===CO2(g)+2H2O(l) ΔH=-725.8 kJ·mol-1 4FeCO3(s)+O2(g)===2Fe2O3(s)+4CO2(g) ΔH=-260 kJ/mol C2H5OH(l)+3O2(g)===2CO2(g)+3H2O(l) ΔH=-2Q kJ·mol-1 299 -139
【解析】(1)n(KOH)=![]() =0.2mol,n(H2SO4)=1L×0.1mol/L=0.1mol,二者发生2KOH(aq)+H2SO4(aq)═K2SO4(aq)+2H2O,生成0.2mol水,则生成1mol水放出57.3kJ热量,中和热为生成1mol水放出的热量,则该反应中和热的化学方程式为KOH(aq)+
=0.2mol,n(H2SO4)=1L×0.1mol/L=0.1mol,二者发生2KOH(aq)+H2SO4(aq)═K2SO4(aq)+2H2O,生成0.2mol水,则生成1mol水放出57.3kJ热量,中和热为生成1mol水放出的热量,则该反应中和热的化学方程式为KOH(aq)+![]() H2SO4(aq)═
H2SO4(aq)═![]() K2SO4(aq)+H2O(l)△H=-57.3kJ/mol;离子方程式为H+(aq)+OH-(aq)===H2O(l) ΔH=-57.3 kJ·mol-1,故答案为:KOH(aq)+
K2SO4(aq)+H2O(l)△H=-57.3kJ/mol;离子方程式为H+(aq)+OH-(aq)===H2O(l) ΔH=-57.3 kJ·mol-1,故答案为:KOH(aq)+![]() H2SO4(aq)═
H2SO4(aq)═![]() K2SO4(aq)+H2O(l)△H=-57.3kJ/mol;H+(aq)+OH-(aq)===H2O(l) ΔH=-57.3 kJ/mol;
K2SO4(aq)+H2O(l)△H=-57.3kJ/mol;H+(aq)+OH-(aq)===H2O(l) ΔH=-57.3 kJ/mol;
(2)2CH3OH(I)十3O2(g)═2CO2(g)+4H2O(g)△H=_1275.6kJmol-1 ①,H2O(l)=H2O(g)△H=+44kJ/mol②,根据盖斯定律,将①-②×4得:2CH3OH(I)十3O2(g)═2CO2(g)+4H2O(g)△H=_1451.6kJmol-1。在25℃,101 kPa时,1 mol可燃物完全燃烧生成稳定的化合物时所放出的热量,叫做该物质的燃烧热。所以表示甲醇燃烧热的热化学方程式:CH3OH(g)+![]() O2(g)=CO2(g)+2H2O(l)△H=-725.8kJ/mol,故答案为:CH3OH(g)+
O2(g)=CO2(g)+2H2O(l)△H=-725.8kJ/mol,故答案为:CH3OH(g)+![]() O2(g)=CO2(g)+2H2O(l)△H=-725.8kJ/mol;
O2(g)=CO2(g)+2H2O(l)△H=-725.8kJ/mol;
(3)发生反应:4FeCO3+O2![]() 2Fe2O3+4CO2,已知:①4Fe(s)+3O2(g)═2Fe2O3(s)△H=-1648kJ/mol,②C(s)+O2(g)═CO2(g)△H=-393kJ/mol,③2Fe(s)+2C(s)+3O2(g)═2FeCO3(s)△H=-1480kJ/mol,根据盖斯定律,①-③×2+②×④可得4FeCO3(s)+O2(g)=2Fe2O3(s)+4CO2(g),故△H=-1648kJ/mol-2×(-1480kJ/mol)+4×(-393kJ/mol)=-260kJ/mol,故反应热化学方程式为:4FeCO3(s)+O2(g)=2Fe2O3(s)+4CO2(g)△H=-260kJ/mol,故答案为:4FeCO3(s)+O2(g)=2Fe2O3(s)+4CO2(g)△H=-260kJ/mol;
2Fe2O3+4CO2,已知:①4Fe(s)+3O2(g)═2Fe2O3(s)△H=-1648kJ/mol,②C(s)+O2(g)═CO2(g)△H=-393kJ/mol,③2Fe(s)+2C(s)+3O2(g)═2FeCO3(s)△H=-1480kJ/mol,根据盖斯定律,①-③×2+②×④可得4FeCO3(s)+O2(g)=2Fe2O3(s)+4CO2(g),故△H=-1648kJ/mol-2×(-1480kJ/mol)+4×(-393kJ/mol)=-260kJ/mol,故反应热化学方程式为:4FeCO3(s)+O2(g)=2Fe2O3(s)+4CO2(g)△H=-260kJ/mol,故答案为:4FeCO3(s)+O2(g)=2Fe2O3(s)+4CO2(g)△H=-260kJ/mol;
(4)因生成的CO2用过量饱和石灰水完全吸收,可得100克CaCO3沉淀,CaCO3的物质的量是1mol,由碳元素守恒可知,二氧化碳的物质的量也为1mol,即生成1mol CO2放出的热量为Q,而完全燃烧1mol C2H5OH时生成2mol CO2,则放出的热量为Q×2=2Q,热化学方程式为:C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(l)△H=-2QkJ/mol,故答案为:C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(l)△H=-2QkJ/mol;
(5)设1mol HI(g)分子中化学键断裂时需吸收的能量为x,反应2HI(g)═H2(g)+I2(g)的△H=+11kJmol-1,1molH2(g)、1mol I2(g)分子中化学键断裂时分别需要吸收436kJ、151kJ的能量,则2x-436-151=△H=+11kJmol-1,解得x=299 kJ;故答案为:299;
(6)N2O(g)+NO(g)=N2(g)+NO2(g),△H=(209-348)kJ/mol=-139kJ/mol,故答案为:-139。

 阅读快车系列答案
阅读快车系列答案