题目内容
【题目】材料是人类文明进步的阶梯,第ⅢA、ⅣA、ⅤA族元素是组成特殊材料的重要元素。请回答下列问题:
(1)基态Ge原子的核外电子有__种不同的空间运动状态。
(2)P、S、Cl的第一电离能由大到小的顺序为__。
(3)M与Ga位于同周期,M3+的一种配合物组成为[M(NH3)5(H2O)]Cl3。
①下列有关NH3、H2O的说法正确的是__(填字母)。
a.分子空间构型相同
b.中心原子杂化类型相同
c.键角大小相同
②1mol[M(NH3)5(H2O)]3+含__个σ键。
③配合物T与[M(NH3)5(H2O)]Cl3组成元素的种类和数目相同,中心离子的配位数相同。1molT溶于水,加入足量AgNO3溶液可生成2molAgCl。则T的化学式为___。
(4)如图甲为硼酸晶体的片层结构,其中硼的杂化方式为__。H3BO3在热水中比冷水中溶解度显著增大的主要原因是__。
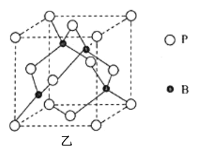
(5)磷化硼(BP)是一种超硬耐磨涂层材料,其晶胞结构如图乙所示,该晶胞中B原子相连构成几何体的空间构型为__(填“立方体”或“正四面体”或“正八面体”)。已知该晶体的密度为ρg·cm-3,NA是阿伏加德罗常数的值。BP晶胞中面心上6个P原子相连构成正八面体,该正八面体的边长为__pm(列式即可)。

【答案】17 Cl>P>S b 23NA [M(NH3)5Cl]Cl2·H2O sp2 热水破坏了硼酸晶体中的氢键,并且硼酸分子与水形成分子间氢键,使溶解度增大 正四面体 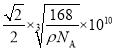
【解析】
(1)根据原子中单个电子的空间运动状态可以用原子轨道来描述可知,Ge原子中有多少原子轨道,就有多少种电子的空间运动状态;
(3)③根据题意,分清配合物中內界离子和外界离子的区别,外界的Cl-能被沉淀,內界的不能形成沉淀,据此判断。
(5)利用均摊法计算晶胞中BP的原子个数,通过公式![]() 、
、![]() 找出晶胞ρ和M、V之间的关系,进而计算出晶胞边长的表示式,根据边长与BP的几何体边长关系,得出答案。
找出晶胞ρ和M、V之间的关系,进而计算出晶胞边长的表示式,根据边长与BP的几何体边长关系,得出答案。
(1)基态Ge原子的核外电子排布式为:1s22s22p63s23p63d104s24p2,共有17个原子轨道,故基态Ge原子的核外电子有17种不同的空间运动状态,答案为:17;
(2) 磷原子3p能级为半充满状态,故磷的第一电离能大于元素硫、但是小于元素氯,故P、S、Cl的第一电离能由大到小的顺序为Cl>P>S;答案为:Cl>P>S;
(3)①根据价层电子对互斥理论,可知,NH3和H2O成键对数分别为3和2,NH3的孤电子对数为![]() ,H2O的孤电子对数为
,H2O的孤电子对数为![]() ,则NH3的空间构型为三角锥形,键角为107°;H2O的空间构型为V形,键角为105°。NH3和H2O中N原子和O原子均采取sp3杂化,N原子的sp3轨道有1个由孤电子对占据,O原子的sp3轨道有2个由孤对电子占据,据此可知,b项正确,答案为:b;
,则NH3的空间构型为三角锥形,键角为107°;H2O的空间构型为V形,键角为105°。NH3和H2O中N原子和O原子均采取sp3杂化,N原子的sp3轨道有1个由孤电子对占据,O原子的sp3轨道有2个由孤对电子占据,据此可知,b项正确,答案为:b;
②NH3和H2O中的共价键都是σ键,每个分子形成一个配位键,配位键也是σ键,所以1个NH3形成4个σ键,1个H2O形成3个σ键。故1 mol[M(NH3)5(H2O)]3+含(5×4+3)NA=23NA个σ键;答案为:23NA;
③该配合物中M3+的配位数为6,依题意,1molT中有2 molCl-在外界,能电离出2 molCl-,有1molCl-形成为內界离子,故T的化学式为[M(NH3)5Cl]Cl2·H2O;答案为:[M(NH3)5Cl]Cl2·H2O;
(4)硼原子最外层只有3个电子,由图甲可知,B原子在硼酸分子中,与氧原子形成3对共用电子对,B原子与3个羟基相连,无孤对电子对,故硼的杂化方式为sp2杂化;H3BO3晶体中存在氢键,热水会破坏硼酸晶体中的氢键,同时硼酸分子可与水分子形成分子间氢键,则硼酸的溶解度增大;故答案为:sp2杂化;热水破坏了硼酸晶体中的氢键,并且硼酸分子与水形成分子间氢键,使溶解度增大;
(5)由图乙可知,P原子将晶胞围成8个正四面体,而B原子位于体对角线的![]() 位置,4个B原子填充了4个正四面体;面心上6个P原子构成正八面体,该正八面体的边长等于面对角线的一半,设BP晶胞边长为acm,1个晶胞中含有B原子数为
位置,4个B原子填充了4个正四面体;面心上6个P原子构成正八面体,该正八面体的边长等于面对角线的一半,设BP晶胞边长为acm,1个晶胞中含有B原子数为![]() ,含有P原子数为
,含有P原子数为![]() ,则,1个晶胞中含有4个BP,根据
,则,1个晶胞中含有4个BP,根据![]() 、
、![]() ,所以
,所以![]() ,a=
,a=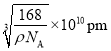 。故正八面体的边长为
。故正八面体的边长为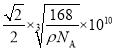 。答案为:正四面体;
。答案为:正四面体;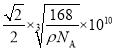 。
。