��Ŀ����
��ҵ�ϲ����ұ���CO2����������Ҫ����ԭ�ϱ���ϩ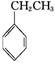 (g)+CO2(g)
(g)+CO2(g)
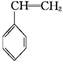 (g)+CO(g)+H2O(g)����H="-166" kJ��mol-1
(g)+CO(g)+H2O(g)����H="-166" kJ��mol-1
(1)���ұ���CO2��Ӧ��ƽ�ⳣ������ʽΪ:K=��������������������������
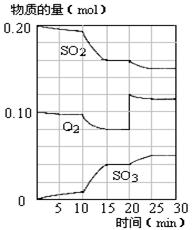
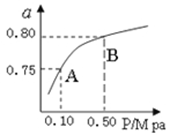
�����÷�Ӧ�ھ��ȡ����ݵ��ܱ���ϵ�н���,����ʾ��ͼ��ȷ����˵����Ӧ�ڽ��е�t1ʱ�̴ﵽƽ��״̬������������(�����)�� 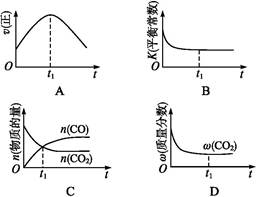
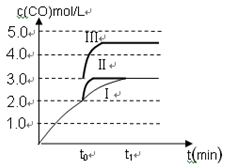
(2)��3 L�ܱ�������,�ұ���CO2�ķ�Ӧ�����ֲ�ͬ�������½���ʵ��,�ұ���CO2����ʼŨ�ȷֱ�Ϊ1.0 mol��L-1��3.0 mol��L-1,����ʵ�����T1��,0.3 MPa,��ʵ���ֱ�ı���ʵ����������;�ұ���Ũ����ʱ��ı仯��ͼ1��ʾ��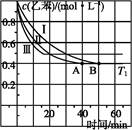
ͼ1 ͼ2
��ʵ����ұ���0~50 minʱ�ķ�Ӧ����Ϊ����������
��ʵ�����ܸı����������������������
��ͼ2��ʵ����б���ϩ�������V%��ʱ��t�ı仯����,����ͼ2�в���ʵ����б���ϩ�������V%��ʱ��t�ı仯���ߡ�
(3)��ʵ����н��ұ�����ʼŨ�ȸ�Ϊ1.2 mol��L-1,������������,�ұ���ת���ʽ���������(�������С�����䡱),�����ʱƽ�ⳣ��Ϊ����������
(1)K=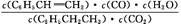 ��BD
��BD
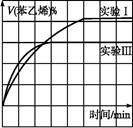
(2)��0.012 mol��L-1��min-1���ڼ������
��
(3)����0.225
����

 ��ѧ�����ϵ�д�
��ѧ�����ϵ�д� �·Ƿ��̸����100��ϵ�д�
�·Ƿ��̸����100��ϵ�д���2 L�ܱ������У�800��ʱ��Ӧ2NO��g����O2��g�� 2NO2��g����ϵ�У�n��NO����ʱ��ı仯�����
2NO2��g����ϵ�У�n��NO����ʱ��ı仯�����
| ʱ��/s | 0 | 1 | 2 | 3 | 4 | 5 |
| n��NO��/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
��1��������Ӧ________����ǡ����ǡ������淴Ӧ��
��2����ͼ��ʾ����ʾNO2�仯���ߵ���______����O2��ʾ��0��2s�ڸ÷�Ӧ��ƽ������v��________��

��3����˵���÷�Ӧ�Ѵﵽƽ��״̬����________������ţ���
a��v��NO2����2v��O2��
b��������ѹǿ���ֲ���
c��v����NO����2v����O2��
d���������ܶȱ��ֲ���
����ʮ�˴����״�����������й����ĺ�ΰĿ�ꡣ���ܼ������й�ת�ͷ�չ�ıؾ�֮·����ҵ����������������ʵ�ֽ��ܼ��ŵ���Ҫ��ʩ����ͼ�Ǽ��ֹ�ҵ�����������������գ�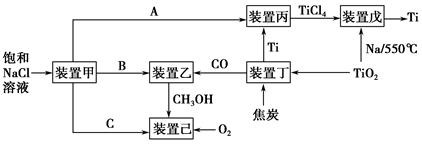
��ش��������⣺
��1��װ�ü�Ϊ���أ�����ͼʾת����ϵ��֪��AΪ____________���ѧʽ����������ӦʽΪ____________��
��2��װ�ñ��ķ�Ӧ��ΪTi����װ�����������ΪTi��������װ���ڸ����������в���ì�ܣ�ԭ����_________________________________________________
װ������з�Ӧʱ��Ҫ�Ļ���Ϊ________������ĸ��ţ���
A��HCl�����Χ�� B��������Χ�� C�������Χ�� D��ˮ��
��3��װ�����з������ǹ�ҵ�ϳɼ״��ķ�Ӧ��CO��g����2H2��g��??CH3OH��g������H<0��
�ٸ÷�Ӧ�ڲ�ͬ�¶��µĻ�ѧƽ�ⳣ����K�����±���
| �¶�/�� | 250 | 350 |
| K | 2.041 | x |
���ϱ��е�ƽ�ⳣ��x����ֵ��________������ĸ��ţ���
A��0 B��0.012 C��32.081 D��100
����װ����Ϊ�ݻ��̶����ܱ���������ͬʱ��θ����ʵ�Ũ�����±���
| | c��CO�� | c��H2�� | c��CH3OH�� |
| 0 min | 0.8 mol��L��1 | 1.6 mol��L��1 | 0 |
| 2 min | 0.6 mol��L��1 | y | 0.2 mol��L��1 |
| 4 min | 0.3 mol��L��1 | 0.6 mol��L��1 | 0.5 mol��L��1 |
| 6 min | 0.3 mol��L��1 | 0.6 mol��L��1 | 0.5 mol��L��1 |
��Ӧ��2 min��4 min֮�䣬H2��ƽ����Ӧ����Ϊ________����Ӧ�ﵽƽ��ʱCO��ת����Ϊ________����Ӧ�ڵ�2 minʱ�ı��˷�Ӧ�������ı������������________������ĸ��ţ���
A��ʹ�ô��� B�������¶�
C������H2��Ũ��
��4��װ�ü����Կ���ȼ�ϵ�أ���ȼ�ϵ�صĸ�����ӦʽΪ____________ ________________________________________________��
��ҵ���Ʊ�H2��һ����Ҫ�����ǣ� CO(g) + H2O(g)  CO2 (g) + H2(g) ��H��Q kJ/mol ����֪�÷�Ӧ��ƽ�ⳣ��K���¶�T�Ĺ�ϵ��ͼ��ʾ������һ�̶����ܱ������У� 850�� ʱ����������Ӧ����������ڸ����ʵ�Ũ�� (mol/L)��ʱ��ı仯��ϵ���±���
CO2 (g) + H2(g) ��H��Q kJ/mol ����֪�÷�Ӧ��ƽ�ⳣ��K���¶�T�Ĺ�ϵ��ͼ��ʾ������һ�̶����ܱ������У� 850�� ʱ����������Ӧ����������ڸ����ʵ�Ũ�� (mol/L)��ʱ��ı仯��ϵ���±���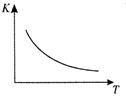
��֪��850�� ʱ�÷�Ӧ�Ļ�ѧƽ�ⳣ��K ="1.0" ����ش��������⣺
��1��Q 0��� �� ������ �� ������ ����
��2�������жϸ÷�Ӧ�ﵽ��ѧƽ��״̬�������� ������ĸ����
| A����λʱ���ڼ��� CO(g)��Ũ�ȵ������� CO2 (g)��Ũ�� |
| B����Ӧ�����ڵ�ѹǿ�������仯 |
| C����������� H2 (g)��Ũ�Ȳ��ٷ����ı� |
| D���������������ʵ���ˮ���������� |
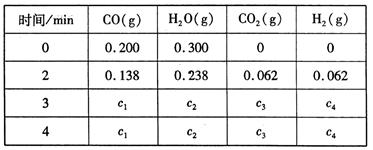
��4���ϱ��� c2Ϊ mol/L , CO(g)��ת����Ϊ
�����̵��ͺϳɵ����ܵ�����Ҫ��ʽ���±��Ǵ����̵��ͺϳɰ��IJ���Kֵ��
| | N2+O2 2NO 2NO | N2+3H2 2NH3 2NH3 | ||
| �¶� | 25�� | 2000�� | 25�� | 400�� |
| ƽ�ⳣ��K | 3.84��10-31 | 0.1 | 5��108 | 200 |
��1�������̵���_______(�����ȡ��������ȡ�)��Ӧ���˹��̵���ũҵ����ʮ���ش��ݱ������ݣ�����֪�ϳɰ�����Ҫ���о�������______________________________________��
��2����ҵ�ϳɰ�ԭ�������Ʊ���Ҫ�������£�
���Կ���Ϊԭ���Ʊ�N2���䷽����______________________________________��
���Խ�̿��ˮΪԭ���Ʊ�H2����Ӧԭ��Ϊ____________________��__________________��
H2�л��е�CO���ô�����ͭ����Һ���գ��Է�ֹ�ϳɰ�ʱ�����ж���
CO(g)+Cu(NH3)2Ac(aq)
 Cu(NH3)2AC��CO(aq)+Q(Q>0)
Cu(NH3)2AC��CO(aq)+Q(Q>0)Ҫ�ӳ��Ӻ����Һ�С���������������ͭ������________(������������)�¡�____(������������)ѹ��
��3��Һ����ˮ���ƣ�Ҳ�������(����)��NH3+NH3
 NH4++NH2-��
NH4++NH2-����Һ�������ӻ����Ա�ʾΪ________________��
��25��ʱ��Һ�������ӻ�K=1.0��10-30������NaNH2�������Һ���У���������Һ�в����ڵĹ�ϵʽ��(���¶ȱ��ֲ���)_________ (ѡ����)
a��c(Na+)=c(NH2-) b��c(NH4+)��c(NH2-)=1.0��10-30 c��c(NH2-)> c(NH4+)
��4������Һ����NaNH2��NH4Cl������ȫ���룬���ñ�NaNH2Һ����Һ�ζ�δ֪Ũ��NH4ClҺ����Һʱ����Ӧ�����ӷ���ʽΪ_______________________��
��ҵ���������Ҫ��Ӧ�ǣ�4NH3(g)+5O2(g) 4NO(g)+6H2O (g) ��H=" -1025" KJ/mol
4NO(g)+6H2O (g) ��H=" -1025" KJ/mol
��1��һ���¶��£��ֽ�0.8mol NH3��1.5mol O2����һ��ѹ�ܱ������У�����ʾ��ͼ��ȷ����˵����Ӧ�ﵽƽ��״̬���� 
��2�����ݻ�Ϊ1L���ܱ������з���������Ӧ�������ڲ������ʵ����ʵ���Ũ�����±���
| ʱ�䣯Ũ�� | c(NH3)(mol/L) | C(O2)(mol/L) | C(NO)(mol/L) |
| ��ʼ | 0.8 | 1.5 | 0 |
| ��2min | 0.7 | a | 0.1 |
| ��4min | 0.4 | 1.0 | 0.4 |
| ��6min | 0.4 | 1.0 | 0.4 |
| ��8min | 1.2 | 2.5 | 0.4 |
����ʼʱ���ϱ�c (O2) : c (NH3)��1.25����ԭ����
�ڷ�Ӧ�ڵ�2min����4minʱO2��ƽ����Ӧ����Ϊ mol��L��1��min��1
�۷�Ӧ�ڵ�2min�ı��˷�Ӧ�������ı������������ ������ĸ��ţ�
a��ʹ�ô��� b�������¶� c������ѹǿ d������O2��Ũ��
�ܷ�Ӧ�ڵ�8min�ı�ķ�Ӧ���������� ���ٴδﵽƽ��ʱ��NO���������
�����������С�����䡱��


 2NH3 ��H=" -" 92.4kJ/mol
2NH3 ��H=" -" 92.4kJ/mol 2NO2(g) ��H��0��ϵ�У����ɷ�Ũ����ʱ��ı仯��ͼ��
2NO2(g) ��H��0��ϵ�У����ɷ�Ũ����ʱ��ı仯��ͼ��
 4CO2(g)��N2(g) ��H����1 200 kJ��mol��1���ڸ÷�Ӧ���¶Ȳ�ͬ(T2>T1)������������ͬʱ������ͼ����ȷ����______(�����)��
4CO2(g)��N2(g) ��H����1 200 kJ��mol��1���ڸ÷�Ӧ���¶Ȳ�ͬ(T2>T1)������������ͬʱ������ͼ����ȷ����______(�����)��
 2SO3
2SO3