��Ŀ����
��450�沢�д��������£������Ϊ1L���ܱպ��������У���������������������·�Ӧ��2SO2+O2 2SO3
2SO3
��1����֪��64g SO2��ȫת��ΪSO3��ų�85kJ������SO2ת��ΪSO3���Ȼ�ѧ����ʽ�� ��
��2���÷�Ӧ�Ļ�ѧƽ�ⳣ������ʽK= ��
��3�������¶ȣ���ѧ��Ӧ�ٶ� ���÷�ӦKֵ�� ��ѹǿ�� ���������С�����䡱��
��4��450��ʱ����һ�ܱ������У�������������������ϣ���Ӧ������SO2��O2��SO3���ʵ����仯��ͼ����Ӧ����ƽ��״̬��ʱ����� ��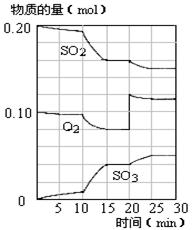
a��10-15min b��15-20min c��20-25min d��25-30min
��5����ͼ�жϣ�10min��15min�����߱仯��ԭ������� ����д��ţ���
a������SO3�����ʵ��� b����С������� c�������¶� d.����
��6����15����ʱ��SO2��ת������ ��
��1��SO2(g)+ O2(g) = SO3(g)����H = -85kJ/mol����2��
O2(g) = SO3(g)����H = -85kJ/mol����2��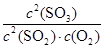
��3������������4��b d��5��c��6��20%
���������������1��������֪��64g SO2Ϊ1mol����ȫת��ΪSO3��ų�����85kJ�������Ȼ�ѧ��Ӧ����ʽSO2(g)+ O2(g)=SO3(g)����H = -85kJ/mol����2�����ݻ�ѧƽ�ⳣ������ʽ����K=
O2(g)=SO3(g)����H = -85kJ/mol����2�����ݻ�ѧƽ�ⳣ������ʽ����K=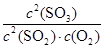 ��3���������Ȼ�ѧ��Ӧ����ʽ������ӦΪ���ȷ�Ӧ�������¶�ƽ�������ƶ�����ѹǿ��С��ƽ�ⳣ��k�������¶ȷ�Ӧ���ʼ�С��4����ƽ��״̬�����������ʵ���Ũ�Ȳ��ٱ仯����ͼ���б���Ϊ���ߣ���bd��ȷ��5����10min��15min�����߱仯��֪��Ӧ�����ʵ����������������ʵ������ߣ���Ӧ������У�����ab�·�Ӧ������У�����c�·�Ӧ������У�����d�²��ı����ʵ����仯����c��ȷ��6��������֪����15����ʱ����Ӧ��SO2���ʵ���Ϊ0.04mol����ʼ���ʵ���Ϊ0.2mol����SO2��ת����Ϊ20%��
��3���������Ȼ�ѧ��Ӧ����ʽ������ӦΪ���ȷ�Ӧ�������¶�ƽ�������ƶ�����ѹǿ��С��ƽ�ⳣ��k�������¶ȷ�Ӧ���ʼ�С��4����ƽ��״̬�����������ʵ���Ũ�Ȳ��ٱ仯����ͼ���б���Ϊ���ߣ���bd��ȷ��5����10min��15min�����߱仯��֪��Ӧ�����ʵ����������������ʵ������ߣ���Ӧ������У�����ab�·�Ӧ������У�����c�·�Ӧ������У�����d�²��ı����ʵ����仯����c��ȷ��6��������֪����15����ʱ����Ӧ��SO2���ʵ���Ϊ0.04mol����ʼ���ʵ���Ϊ0.2mol����SO2��ת����Ϊ20%��
���㣺���ʵ�����Ũ����ʱ��ı仯���ߣ���ѧƽ�⽨���Ĺ���

�̶�������CO2����Ч��������Դ�������ٿ����е��������塣��ҵ����һ����CO�������״�ȼ�ϵķ����� CO2(g)��3H2(g) CH3OH(g)��H2O(g) ��H �� ��49.0 kJ��mol��1��
CH3OH(g)��H2O(g) ��H �� ��49.0 kJ��mol��1��
ij��ѧʵ�齫6molCO2��8molH2����2L���ܱ������У����H2�����ʵ�����ʱ��仯����ͼ��ʾ��ʵ�ߣ���
��1��a������Ӧ����_______������ڡ����ڻ�С�ڣ��淴Ӧ���ʡ�
��2������ʱ���ƽ����Ӧ����������__________��
| A��0��1min | B��1��3min | C��3��8min | D��8��11min |
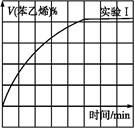
��4�����ı�ijһʵ�������ٽ�������ʵ�飬���H2�����ʵ�����ʱ��仯��ͼ��������ʾ������I��Ӧ��ʵ�������ı��� ������II��Ӧ��ʵ�������ı��� ��
���ô�������Ӧ��SO2ת��ΪSO3�ǹ�ҵ����������Ĺؼ����衣
��֪��SO2��g���� O2��g��
O2��g�� SO3��g�� ��H����98 kJ��mol��1��
SO3��g�� ��H����98 kJ��mol��1��
��1��ij�¶��¸÷�Ӧ��ƽ�ⳣ��K��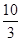 �����ڴ��¶��£���100 L�ĺ����ܱ������У�����3.0 mol SO2(g)��16.0 mol O2(g)��3.0 mol SO3(g)����Ӧ��ʼʱv������ v���棩�����������������������
�����ڴ��¶��£���100 L�ĺ����ܱ������У�����3.0 mol SO2(g)��16.0 mol O2(g)��3.0 mol SO3(g)����Ӧ��ʼʱv������ v���棩�����������������������
��2��һ���¶��£���һ�����������Ϊ2 L���ܱ������г���2.0 mol SO2��1.0 molO2���ﵽƽ��������Ϊ1.6 L����SO2��ƽ��ת����Ϊ ��
��3���ڣ�2���еķ�Ӧ�ﵽƽ��ı�������������ʹSO2(g)ƽ��Ũ�ȱ�ԭ����С���� ������ĸ����
| A�������¶Ⱥ�����������䣬����1.0 mol O2 |
| B�������¶Ⱥ�������ѹǿ���䣬����1.0 mol SO3 |
| C�������¶� |
| D���ƶ�����ѹ������ |
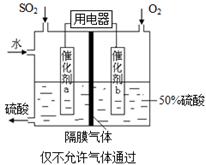
��5��Ϊ�ȶ�����������������Һ��Ũ��Ӧά�ֲ��䣬��ͨ��SO2��ˮ��������Ϊ_____��
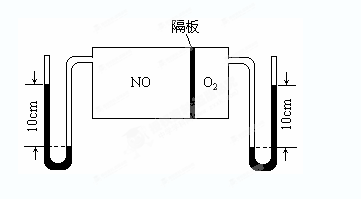
���ж������������N2O5��һ�������������������ʺ��Ʊ��յ����ǵĹ�ע��
��1��һ���¶��£��ں����ܱ�������N2O5�ɷ������з�Ӧ��2N2O5(g) 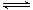 4NO2(g)��O2(g) ���SH��0
4NO2(g)��O2(g) ���SH��0
�ٷ�Ӧ�ﵽƽ�������ͨ��һ�����������N2O5��ת���ʽ�___�����������С���������䡱����
���±�Ϊ��Ӧ��T1�¶��µIJ���ʵ�����ݣ�
| t/s | 0 | 500 | 1000 |
| c(N2O5)/mol��L��1 | 5.00 | 3.52 | 2.48 |
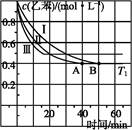
��һ���¶��£���2L�����ܱ������м���2mol N2O5���ﵽƽ��ʱ�������ѹǿΪԭ����
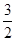 ��(������NO2�ۺϳ�N2O4)����N2O5��ת����a1�� �����¶��·�Ӧ��ƽ�ⳣ��K��_______��
��(������NO2�ۺϳ�N2O4)����N2O5��ת����a1�� �����¶��·�Ӧ��ƽ�ⳣ��K��_______����2����ͼ��ʾװ�ÿ������Ʊ�N2O5����N2O5�ڵ��ص�__________�����ɣ���缫��ӦʽΪ_________________________________��
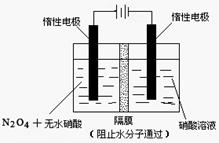
��3����ͼ��V(NO):V(O2)��3:1������ȥNO��O2֮��ĸ����NO��O2��Ӧ���NO2������NO2�ۺϳ�N2O4��N2O4��ʱΪ��̬��������ϵ�ﵽƽ���U��ëϸ�����˹���߶Ȳ��ɷ�Ӧǰ10cm��Ϊ7.1cm�������¶Ȳ��䣬�Ҹ��弰U��ëϸ�ܵ���������Բ��ƣ���ʱ��������ƽ����Է�������Ϊ__________��
�������������ʡ����ᡢ����ȵ���Ҫԭ�ϡ�
��1��ʵ����ģ��ϳɰ����ں��º����ܱ������а��ռס��ҡ������ַ�ʽ�ֱ�Ͷ�ϣ���λ��mol /L����ƽ��ʱ��ü�������H2��ת����Ϊ20%��
| | N2 | H2 | NH3 |
| �� | 1 | 3 | 0 |
| �� | 0.5 | 1.5 | 1 |
| �� | 0 | 0 | 4 |
��ƽ��ʱ�������а�����Ũ��Ϊ ��
���������п�ʼ��Ӧʱ��v�� v��(�������)��
�۴�ƽ��ʱ���ס��ҡ�����������NH3����������ɴ�С��˳��Ϊ ��
��2����ҵ����NH3��CO2Ϊԭ�Ϻϳ�����[CO(NH2)2]����Ӧ�Ļ�ѧ����ʽΪ��
2NH3 (g)+ CO2 (g)
 CO(NH2)2 (l) + H2O (l)���÷�Ӧ��ƽ�ⳣ�����¶ȹ�ϵ���£�
CO(NH2)2 (l) + H2O (l)���÷�Ӧ��ƽ�ⳣ�����¶ȹ�ϵ���£�| T / �� | 165 | 175 | 185 | 195 |
| K | 111.9 | 74.1 | 50.6 | 34.8 |
���ʱ䦤H_____0�����������������������
����һ���¶Ⱥ�ѹǿ�£���ԭ�����е�NH3��CO2�����ʵ���֮�ȣ���̼�ȣ�
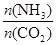 ��x����ͼ�ǰ�̼�ȣ�x����CO2ƽ��ת���ʣ������Ĺ�ϵ��������x����������ԭ���� ��
��x����ͼ�ǰ�̼�ȣ�x����CO2ƽ��ת���ʣ������Ĺ�ϵ��������x����������ԭ���� ��
����ͼ�е�B�㴦��NH3��ƽ��ת����Ϊ ��
 CH3OH(g)�������ͼʾ�ش��������⣺
CH3OH(g)�������ͼʾ�ش��������⣺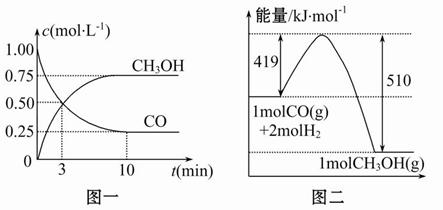
 (g)+CO2(g)
(g)+CO2(g)
 (g)+CO(g)+H2O(g)����H="-166" kJ��mol-1
(g)+CO(g)+H2O(g)����H="-166" kJ��mol-1
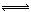 CH3OH(g)��
CH3OH(g)��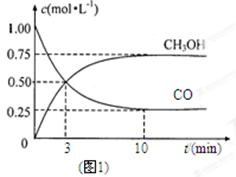
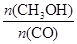 ����Ĵ�ʩ�� ��
����Ĵ�ʩ�� ��