��Ŀ����
�����̵��ͺϳɵ����ܵ�����Ҫ��ʽ���±��Ǵ����̵��ͺϳɰ��IJ���Kֵ��
| | N2+O2 2NO 2NO | N2+3H2 2NH3 2NH3 | ||
| �¶� | 25�� | 2000�� | 25�� | 400�� |
| ƽ�ⳣ��K | 3.84��10-31 | 0.1 | 5��108 | 200 |
��1�������̵���_______(�����ȡ��������ȡ�)��Ӧ���˹��̵���ũҵ����ʮ���ش��ݱ������ݣ�����֪�ϳɰ�����Ҫ���о�������______________________________________��
��2����ҵ�ϳɰ�ԭ�������Ʊ���Ҫ�������£�
���Կ���Ϊԭ���Ʊ�N2���䷽����______________________________________��
���Խ�̿��ˮΪԭ���Ʊ�H2����Ӧԭ��Ϊ____________________��__________________��
H2�л��е�CO���ô�����ͭ����Һ���գ��Է�ֹ�ϳɰ�ʱ�����ж���
CO(g)+Cu(NH3)2Ac(aq)
 Cu(NH3)2AC��CO(aq)+Q(Q>0)
Cu(NH3)2AC��CO(aq)+Q(Q>0)Ҫ�ӳ��Ӻ����Һ�С���������������ͭ������________(������������)�¡�____(������������)ѹ��
��3��Һ����ˮ���ƣ�Ҳ�������(����)��NH3+NH3
 NH4++NH2-��
NH4++NH2-����Һ�������ӻ����Ա�ʾΪ________________��
��25��ʱ��Һ�������ӻ�K=1.0��10-30������NaNH2�������Һ���У���������Һ�в����ڵĹ�ϵʽ��(���¶ȱ��ֲ���)_________ (ѡ����)
a��c(Na+)=c(NH2-) b��c(NH4+)��c(NH2-)=1.0��10-30 c��c(NH2-)> c(NH4+)
��4������Һ����NaNH2��NH4Cl������ȫ���룬���ñ�NaNH2Һ����Һ�ζ�δ֪Ũ��NH4ClҺ����Һʱ����Ӧ�����ӷ���ʽΪ_______________________��
��1�����ȣ�1�֣���Ѱ�ҳ������ܷ�����Ӧ�Ĵ�����1�֣���
��2���ٽ�������ѹʹ��Һ����Ȼ���������������������������������̼�ڿ�����ȼ�գ���ȥCO2����1�֣���
��C(s)+ H2O (g) CO+ H2(1��)��CO+ H2O (g)
CO+ H2(1��)��CO+ H2O (g) CO2+ H2O(1��)����������2�֣���
CO2+ H2O(1��)����������2�֣���
��3���� K= c(NH4+)?c(NH2-)(1��) ��a(2��)
��4��NH4++ NH2-��2NH3(2��)
���������������1�����ݱ������ݣ��¶����ߣ�ƽ�ⳣ�����ӣ�˵�������̵������ȷ�Ӧ���˹��̵���ũҵ����ʮ���ش��ݱ������ݣ�����֪�ϳɰ�����Ҫ���о�������Ѱ�ҳ������ܷ�����Ӧ�Ĵ�����
��2�����Կ���Ϊԭ���Ʊ�N2���䷽���ǽ�������ѹʹ��Һ����Ȼ���������������������������������̼�ڿ�����ȼ�գ���ȥCO2�������Խ�̿��ˮΪԭ���Ʊ�H2����Ӧԭ��ΪC(s)+ H2O (g)=CO+ H2(1��)��CO+ H2O (g)=CO2+ H2O��CO(g)+Cu(NH3)2Ac(aq)  Cu(NH3)2AC��CO(aq)+Q(Q>0)����Ӧ�Ƿ��ȷ�Ӧ�� Ҫ�ӳ��Ӻ����Һ�С���������������ͭ���������½�ѹ����ʹƽ�����Ƽ��ɡ�
Cu(NH3)2AC��CO(aq)+Q(Q>0)����Ӧ�Ƿ��ȷ�Ӧ�� Ҫ�ӳ��Ӻ����Һ�С���������������ͭ���������½�ѹ����ʹƽ�����Ƽ��ɡ�
��3��NH3+NH3 NH4++NH2-����Һ�������ӻ����Ա�ʾΪK= c(NH4+)?c(NH2-)��������Һ���ܵ����NH2-��������NaNH2ʱ�����NH2-�����������ӵ����϶���ȣ�������ԭNH2-ʱ������c(Na+)<(NH2-) ,a����
NH4++NH2-����Һ�������ӻ����Ա�ʾΪK= c(NH4+)?c(NH2-)��������Һ���ܵ����NH2-��������NaNH2ʱ�����NH2-�����������ӵ����϶���ȣ�������ԭNH2-ʱ������c(Na+)<(NH2-) ,a����
��4������Һ����NaNH2��NH4Cl������ȫ���룬���ñ�NaNH2Һ����Һ�ζ�δ֪Ũ��NH4ClҺ����Һʱ����Ӧ�����ӷ���ʽΪNH4++ NH2-��2NH3��
���㣺���⿼�黯ѧƽ�ⳣ�������ã�ƽ���ƶ��͵���ƽ������ӵķ�����

 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д���1.0 L�ܱ������з���0.10 mol A��g������һ���¶Ƚ������·�Ӧ��A��g��  B��g����C��g������H����85.1 kJ��mol��1
B��g����C��g������H����85.1 kJ��mol��1
��Ӧʱ�䣨t����������������ѹǿ��p�������ݼ��±���
| ʱ��t/h | 0 | 1 | 2 | 4 | 8 | 16 | 20 | 25 | 30 |
 | 4.91 | 5.58 | 6.32 | 7.31 | 8.54 | 9.50 | 9.52 | 9.53 | 9.53 |
�ش��������⣺
��1�������A��ƽ��ת���ʣ�Ӧ��ȡ�Ĵ�ʩΪ________��
��2������ѹǿp����ʼѹǿP0���㷴Ӧ��A��ת����a��A���ı���ʽΪ________��ƽ��ʱA��ת����Ϊ________����ʽ�����㷴Ӧ��ƽ�ⳣ��K________��
��3��������ѹǿp����ʼѹǿP0��ʾ��Ӧ��ϵ�������ʵ���n���ܣ��ͷ�Ӧ��A�����ʵ���n��A����n���ܣ���________mol��n��A����________mol��
���±�Ϊ��Ӧ��AŨ���뷴Ӧʱ������ݣ����㣺a��________��
| ��Ӧʱ��t/h | 0 | 4 | 8 | 16 |
| c��A��/��mol��L��1�� | 0.10 | a | 0.026 | 0.0065 |
�����÷�Ӧ�з�Ӧ���Ũ��c��A���仯��ʱ������t���Ĺ��ɣ��ó��Ľ�����________���ɴ˹����Ƴ���Ӧ��12 hʱ��Ӧ���Ũ��c��A��Ϊ________mol��L��1��
���ô�������Ӧ��SO2ת��ΪSO3�ǹ�ҵ����������Ĺؼ����衣
��֪��SO2��g���� O2��g��
O2��g�� SO3��g�� ��H����98 kJ��mol��1��
SO3��g�� ��H����98 kJ��mol��1��
��1��ij�¶��¸÷�Ӧ��ƽ�ⳣ��K��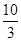 �����ڴ��¶��£���100 L�ĺ����ܱ������У�����3.0 mol SO2(g)��16.0 mol O2(g)��3.0 mol SO3(g)����Ӧ��ʼʱv������ v���棩�����������������������
�����ڴ��¶��£���100 L�ĺ����ܱ������У�����3.0 mol SO2(g)��16.0 mol O2(g)��3.0 mol SO3(g)����Ӧ��ʼʱv������ v���棩�����������������������
��2��һ���¶��£���һ�����������Ϊ2 L���ܱ������г���2.0 mol SO2��1.0 molO2���ﵽƽ��������Ϊ1.6 L����SO2��ƽ��ת����Ϊ ��
��3���ڣ�2���еķ�Ӧ�ﵽƽ��ı�������������ʹSO2(g)ƽ��Ũ�ȱ�ԭ����С���� ������ĸ����
| A�������¶Ⱥ�����������䣬����1.0 mol O2 |
| B�������¶Ⱥ�������ѹǿ���䣬����1.0 mol SO3 |
| C�������¶� |
| D���ƶ�����ѹ������ |
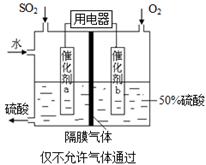
��5��Ϊ�ȶ�����������������Һ��Ũ��Ӧά�ֲ��䣬��ͨ��SO2��ˮ��������Ϊ_____��
KI��Һ����������������������Ӧ����������ʵ���¼��
| ʵ���� | �� | �� | �� | �� | �� |
| �¶ȣ��棩 | 30 | 40 | 50 | 60 | 70 |
| ��ɫʱ�䣨s�� | 160 | 80 | 40 | 20 | 10 |
��1���÷�Ӧ�����ӷ���ʽΪ ��
��2����ʵ���Ŀ���� ��
��3��ʵ���Լ�����1 mol/L KI��Һ��0.1 mol/L H2SO4��Һ�⣬����Ҫ���Լ��� ��ʵ������Ϊ ��
��4������ʵ������г�����Ҫ��3���������⣬��������Ʋ������ (����ĸ)��
A���¶� B���Լ���Ũ�� C���Լ�������(���) D���Լ����ӵ�˳��
��5��������ʵ���¼�ɵó��Ľ����� ��
��6����Ҫ�������ԶԷ�Ӧ���ʵ�Ӱ���̽��ʵ�飬����ȡ�Ĵ�ʩ�� ��
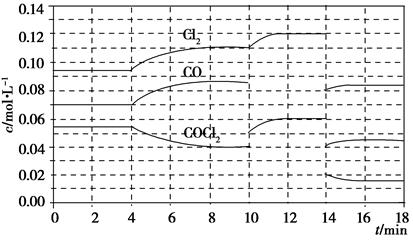
 (g)+CO2(g)
(g)+CO2(g)
 (g)+CO(g)+H2O(g)����H="-166" kJ��mol-1
(g)+CO(g)+H2O(g)����H="-166" kJ��mol-1
 2NH3 (g) ��H=" -" 92.4kJ/mol
2NH3 (g) ��H=" -" 92.4kJ/mol 2NO2(g)��H��0��ϵ�У����ɷ�Ũ����ʱ��ı仯��ͼ��
2NO2(g)��H��0��ϵ�У����ɷ�Ũ����ʱ��ı仯��ͼ��
 4CO2(g)��N2(g) ��H����1 200 kJ��mol��1
4CO2(g)��N2(g) ��H����1 200 kJ��mol��1
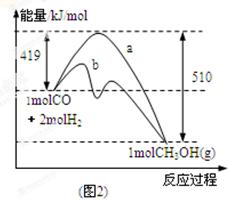
 CH3OH(g)��
CH3OH(g)��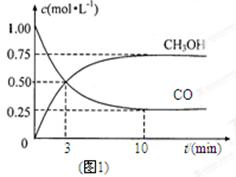
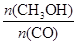 ����Ĵ�ʩ�� ��
����Ĵ�ʩ�� ��