题目内容
工业制硝酸的主要反应是:4NH3(g)+5O2(g) 4NO(g)+6H2O (g) ΔH=" -1025" KJ/mol
4NO(g)+6H2O (g) ΔH=" -1025" KJ/mol
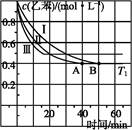
(1)一定温度下,现将0.8mol NH3和1.5mol O2充入一恒压密闭容器中,下列示意图正确且能说明反应达到平衡状态的是 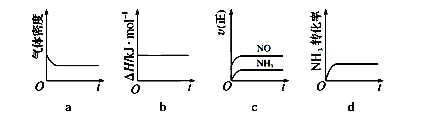
(2)在容积为1L的密闭容器中发生上述反应,容器内部分物质的物质的量浓度如下表:
| 时间/浓度 | c(NH3)(mol/L) | C(O2)(mol/L) | C(NO)(mol/L) |
| 起始 | 0.8 | 1.5 | 0 |
| 第2min | 0.7 | a | 0.1 |
| 第4min | 0.4 | 1.0 | 0.4 |
| 第6min | 0.4 | 1.0 | 0.4 |
| 第8min | 1.2 | 2.5 | 0.4 |
①起始时物料比c (O2) : c (NH3)>1.25,其原因是
②反应在第2min到第4min时O2的平均反应速率为 mol·L-1·min-1
③反应在第2min改变了反应条件,改变的条件可能是 (填字母序号)
a.使用催化剂 b.升高温度 c.增大压强 d.增加O2的浓度
④反应在第8min改变的反应条件可能是 ,再次达到平衡时,NO的体积分数
(填“增大”、“减小”或“不变”)
(1)、ad (2)、①提高NH3转化率 ②0.1875 ③ab ④增加反应物浓度 减少
解析试题分析:(1)恒压条件,质量不变,密度不变,体积也不变,故平衡;转化率不变平衡,选a d
(2)①增大O2的浓度,提高NH3的转化率,③起始浓度没有变化,反应速率加快,故选ab④增加反应物的浓度,该反应特点为气体体积增大的反应,增大浓度相当于加压,故NO体积分数减少。
考点:考查影响化学平衡的因素等相关知识。

利用催化氧化反应将SO2转化为SO3是工业上生产硫酸的关键步骤。
已知:SO2(g)+ O2(g)
O2(g) SO3(g) △H=-98 kJ·mol-1。
SO3(g) △H=-98 kJ·mol-1。
(1)某温度下该反应的平衡常数K=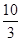 ,若在此温度下,向100 L的恒容密闭容器中,充入3.0 mol SO2(g)、16.0 mol O2(g)和3.0 mol SO3(g),则反应开始时v(正) v(逆)(填“<”、“>”或“=”)。
,若在此温度下,向100 L的恒容密闭容器中,充入3.0 mol SO2(g)、16.0 mol O2(g)和3.0 mol SO3(g),则反应开始时v(正) v(逆)(填“<”、“>”或“=”)。
(2)一定温度下,向一带活塞的体积为2 L的密闭容器中充入2.0 mol SO2和1.0 molO2,达到平衡后体积变为1.6 L,则SO2的平衡转化率为 。
(3)在(2)中的反应达到平衡后,改变下列条件,能使SO2(g)平衡浓度比原来减小的是 (填字母)。
| A.保持温度和容器体积不变,充入1.0 mol O2 |
| B.保持温度和容器内压强不变,充入1.0 mol SO3 |
| C.降低温度 |
| D.移动活塞压缩气体 |
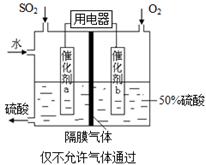
(5)为稳定持续生产,硫酸溶液的浓度应维持不变,则通入SO2和水的质量比为_____。
氮有多种氧化物,其中N2O5是一种新型硝化剂,其性质和制备收到人们的关注。
(1)一定温度下,在恒容密闭容器中N2O5可发生下列反应:2N2O5(g) 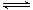 4NO2(g)+O2(g) ;⊿H>0
4NO2(g)+O2(g) ;⊿H>0
①反应达到平衡后,若再通入一定量氩气,则N2O5的转化率将___(填“增大”、“减小”、“不变”)。
②下表为反应在T1温度下的部分实验数据:
| t/s | 0 | 500 | 1000 |
| c(N2O5)/mol·L—1 | 5.00 | 3.52 | 2.48 |
③一定温度下,在2L恒容密闭容器中加入2mol N2O5,达到平衡时,气体的压强为原来的
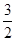 ,(不考虑NO2聚合成N2O4),则N2O5的转化率a1= ,该温度下反应的平衡常数K=_______。
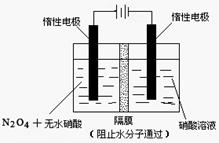
,(不考虑NO2聚合成N2O4),则N2O5的转化率a1= ,该温度下反应的平衡常数K=_______。(2)如图所示装置可用于制备N2O5,则N2O5在电解池的__________区生成,其电极反应式为_________________________________。
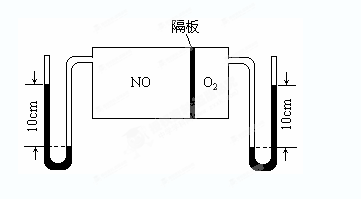
(3)如图:V(NO):V(O2)=3:1。当抽去NO和O2之间的隔板后,NO和O2反应后成NO2,部分NO2聚合成N2O4(N2O4此时为气态)。当体系达到平衡后,U形毛细管两端汞面高度差由反应前10cm变为7.1cm。假设温度不变,且隔板及U形毛细管的体积都忽略不计,此时混合气体的平均相对分子质量为__________。
把大气中的游离态的氮转化为氮的化合物的过程称为固氮。生物固氮和大气固氮(闪电时N2转化为NO)属于自然固氮,这远不能满足人类的需要。工业固氮(合成氨)是目前人工固氮的主要方法。有关大气固氮和工业固氮的平衡常数K值分别如下表一和表二。
表一:N2+ O2 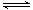 2NO
2NO
| 温度 | 27℃ | 2000℃ |
| K值 | 3.84×10-31 | 0.1 |
表二:N2+ 3H2
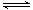 2NH3
2NH3 | 温度 | 25℃ | 350℃ | 400℃ | 450℃ |
| K值 | 5×108 | 1.847 | 0.507 | 0.152 |
A、N2+ O2
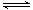 2NO是吸热反应
2NO是吸热反应B、人类大规模模拟大气固氮是没有意义的
C、在常温下,增加工业固氮的容器的压强,K值会发生改变
D、工业固氮是放热反应
(2)向某密闭容器中加入4 mol NH3、1.2 mol H2和一定量的N2三种气体,一定条件下发生反应,各物质的浓度随时间变化如甲图所示[已知0~t1阶段保持恒温、恒容,且c(N2)未画出]。乙图为t2时刻后改变反应条件,反应速率随时间的变化情况,已知在t2、t3、t4、t5时刻各改变一种不同的条件。
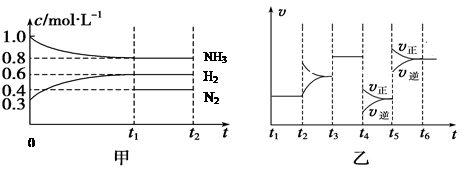
①若t1="15" s,则t0~t1阶段的反应速率为v(H2)=
②N2的起始物质的量为
③反应达到平衡状态,下列说法中能表明已达到平衡状态的是
A、单位时间内生成a molN2,同时生成3a mol H2 B、容器的总压强不再变化
C、混合气体的密度不再变化 D、三个H—H 键断裂的同时有六个H—N键断裂
④t4时刻改变的条件为 ,t5时刻改变的条件为
⑤已知t0~t1阶段该反应放出或吸收的热量为Q kJ(Q为正值),试写出该反应的热化学方程式:____________________________________________________________________
KI溶液在酸性条件下能与氧气反应。现有以下实验记录:
| 实验编号 | ① | ② | ③ | ④ | ⑤ |
| 温度(℃) | 30 | 40 | 50 | 60 | 70 |
| 显色时间(s) | 160 | 80 | 40 | 20 | 10 |
(1)该反应的离子方程式为 。
(2)该实验的目的是 。
(3)实验试剂除了1 mol/L KI溶液、0.1 mol/L H2SO4溶液外,还需要的试剂是 ,实验现象为 。
(4)上述实验操作中除了需要(3)的条件外,还必须控制不变的是 (填字母)。
A.温度 B.试剂的浓度 C.试剂的用量(体积) D.试剂添加的顺序
(5)由上述实验记录可得出的结论是 。
(6)若要进行酸性对反应速率的影响的探究实验,你会采取的措施是 。
氨气是生产氮肥、硝酸、纯碱等的重要原料。
(1)实验室模拟合成氨。在恒温恒容密闭容器中按照甲、乙、丙三种方式分别投料(单位是mol /L),平衡时测得甲容器中H2的转化率为20%。
| | N2 | H2 | NH3 |
| 甲 | 1 | 3 | 0 |
| 乙 | 0.5 | 1.5 | 1 |
| 丙 | 0 | 0 | 4 |
①平衡时甲容器中氨气的浓度为 。
②乙容器中开始反应时,v逆 v正(填<、>或=)。
③达平衡时,甲、乙、丙三容器中NH3的体积分数由大到小的顺序为 。
(2)工业上以NH3和CO2为原料合成尿素[CO(NH2)2],反应的化学方程式为:
2NH3 (g)+ CO2 (g)
 CO(NH2)2 (l) + H2O (l),该反应的平衡常数和温度关系如下:
CO(NH2)2 (l) + H2O (l),该反应的平衡常数和温度关系如下:| T / ℃ | 165 | 175 | 185 | 195 |
| K | 111.9 | 74.1 | 50.6 | 34.8 |
①焓变ΔH_____0(填“>”、“<”或“=”)。
②在一定温度和压强下,若原料气中的NH3和CO2的物质的量之比(氨碳比)
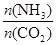 =x,下图是氨碳比(x)与CO2平衡转化率(α)的关系。α随着x增大而增大的原因是 。
=x,下图是氨碳比(x)与CO2平衡转化率(α)的关系。α随着x增大而增大的原因是 。
③右图中的B点处,NH3的平衡转化率为 。
(14分)某化学反应2A(g) B(g)+D(g)在四种不同条件下进行,B、D起始浓度为零,反应物A的浓度(mol/L)随反应时间(min)的变化情况,根据下述数据,完成下列填空:
B(g)+D(g)在四种不同条件下进行,B、D起始浓度为零,反应物A的浓度(mol/L)随反应时间(min)的变化情况,根据下述数据,完成下列填空:
| 实验 序号 | 温度/℃ | 时间/min | ||||||
| 0 | 10 | 20 | 30 | 40 | 50 | 60 | ||
| 1 | 800℃ | 1.0 | 0.80 | 0.67 | 0.57 | 0.50 | 0.50 | 0.50 |
| 2 | 800℃ | c2 | 0.60 | 0.50 | 0.50 | 0.50 | 0.50 | 0.50 |
| 3 | 800℃ | c 3 | 0.92 | 0.75 | 0.63 | 0.60 | 0.60 | 0.60 |
| 4 | 820℃ | 1.0 | 0.40 | 0.25 | 0.20 | 0.20 | 0.20 | 0.20 |
(1)在实验l过程中,10 min~20 min时间内用B表示该反应的平均化学反应速率为 mol/(L·min)。
(2)在实验2过程中,A的初始浓度c2= mol/L,反应经20min就达到平衡,可推测实验2中还隐含的条件是 。
(3)设实验3的化学反应速率为v3,实验1的化学反应速率为v1,则v3 v1,且c3 1.0 mol/L (填“<”、“>”或“=”)。
(4)比较实验4和实验l,可推测该反应是 反应(填“吸热”或“放热”)。理由是
。
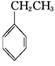 (g)+CO2(g)
(g)+CO2(g)
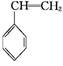 (g)+CO(g)+H2O(g) ΔH="-166" kJ·mol-1
(g)+CO(g)+H2O(g) ΔH="-166" kJ·mol-1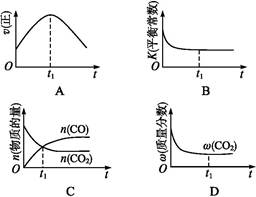
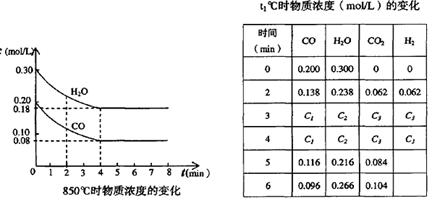
 CO2(g)十H2 (g) △H < 0 ;CO和H2O浓度变化如下图,则 0—4min的平均反应速率v(CO)=______ mol/(L·min)
CO2(g)十H2 (g) △H < 0 ;CO和H2O浓度变化如下图,则 0—4min的平均反应速率v(CO)=______ mol/(L·min)