题目内容
1.某校课外活动小组同学设计如图甲实验,探究木炭与浓硫酸在加热条件下反应生成气体的成分.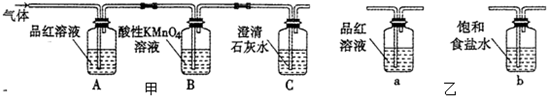
【实验探究】
(1)木炭与浓硫酸反应的化学方程式:C+2H2SO4(浓)$\frac{\underline{\;加热\;}}{\;}$CO2↑+2SO2↑+2H2O,其中浓H2 S04所起的作用是氧化剂(填“氧化剂”或“还原剂”).若有0.2mol碳的完全反应,则消耗H2S04的质量是39.2g,标况下产生SO2的体积为8.96L.
(2)A装置中品红溶液颜色褪色(填“褪色”或“不褪色”),证明含有SO2(或二氧化硫)气体.
(3)实验过程中,装置C将观察到的现象是石灰水变浑浊.
【实验讨论】
(4)有同学对B装置能否除尽SO2气体有疑义.你认为应该在B、C装置之间连接如图乙中a装置,以确认S02是否除尽.
【联系实际】
(5)煤和石油的燃烧过程中都有二氧化硫和二氧化碳排放,其中二氧化硫造成的环境影响主要是A,二氧化碳造成的环境影响主要是C.(每空格只填一个选项)
A.酸雨 B.破坏臭氧层 C.温室效应.
分析 (1)根据硫酸中S元素的化合价变化判断浓硫酸的作用;根据反应方程式计算出参加反应的硫酸、二氧化硫的物质的量,再根据m=nM计算出硫酸质量,根据V=nVm计算出标况下二氧化硫的体积;
(2)二氧化硫具有漂白性,能够使品红溶液褪色,据此可以检验二氧化硫;
(3)二氧化碳能够与澄清石灰水反应生成碳酸钙沉淀;
(4)用品红溶液具有是否存在二氧化硫气体;
(5)空气中含有大量二氧化硫气体,会组成酸雨现象;温室效应的罪魁祸首为二氧化碳.
解答 解:(1)碳与浓硫酸反应的化学方程式为:C+2H2SO4(浓)$\frac{\underline{\;加热\;}}{\;}$CO2↑+2SO2↑+2H2O,该反应中浓硫酸中硫元素化合价降低被含有,所以浓硫酸在反应中作氧化剂;若有0.2molC完全反应,会消耗0.4mol硫酸,同时生成0.4mol二氧化硫,其中消耗硫酸的质量为:98g/mol×0.4mol=39.2g;生成的二氧化硫在标况下的体积为:22.4L/mol×0.4mol=8.96L,
故答案为:氧化剂;39.2;8.96;
(2)反应中有二氧化硫生成,则图1A装置中品红溶液颜色褪色,证明了混合气体中含有SO2,
故答案为:褪色; SO2(或二氧化硫);
(3)反应生成的混合气体中含有二氧化碳,二氧化碳与氢氧化钙反应生成碳酸钙沉淀,所以装置C中的澄清石灰水变浑浊,
故答案为:石灰水变浑浊;
(4)二氧化硫能够使品红溶液褪色,应该在B、C装置之间连接乙中的a-品红溶液,用于检验二氧化硫气体是否除尽,
故答案为:a;
(5)煤和石油的燃烧过程中都有二氧化硫和二氧化碳排放,其中二氧化硫造成的环境影响主要是酸雨,所以A正确;二氧化碳造成的环境影响主要是温室效应,所以C正确,而臭氧层破坏是氟利昂造成的,
故答案为:A;C.
点评 本题考查了性质实验方案的设计方法、二氧化硫的化学性质,题目难度中等,注意掌握浓硫酸的化学性质,明确二氧化硫、二氧化碳的化学性质及检验方法、检验顺序.

 尖子生新课堂课时作业系列答案
尖子生新课堂课时作业系列答案 英才计划同步课时高效训练系列答案
英才计划同步课时高效训练系列答案| A. | 醛基的结构简式:-CHO | B. | 溴乙烷的电子式: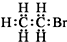 | ||
| C. | 乙炔分子的结构式:H-C≡C-H | D. | 乙醇的分子式:C2H6O |
| A. | 第二周期元素从C到F,非金属性逐渐减弱 | |
| B. | 第三周期元素从Na到Cl,原子半径逐渐增大 | |
| C. | HF、HCl、HBr、HI的热稳定性依次逐渐增强 | |
| D. | LiOH、NaOH、KOH的碱性依次逐渐增强 |
| A. | 78g Na2O2固体中所含阴阳离子个数均为2NA | |
| B. | 1.5g CH3+中含有的电子数为0.9NA | |
| C. | 3.4g氨气中含0.6NA个N-H键 | |
| D. | PCl3和BCl3分子中所有原子的最外层都达到8电子稳定结构 |
①量筒 ②酒精灯 ③玻璃棒 ④蒸发皿 ⑤烧杯 ⑥天平.
| A. | ①②③⑥ | B. | ①④⑤ | C. | ①②③④ | D. | ①③⑤ |
| A. | $\frac{a}{b}$ | B. | $\frac{a}{2b}$ | C. | $\frac{a}{a+2b}$ | D. | $\frac{a}{2a+2b}$ |

| A. | 沉淀甲为SiO2 | |
| B. | 生成沉淀乙的反应为:Fe3++3OH-=Fe(OH)3↓ | |
| C. | 溶液乙中含有AlO2- | |
| D. | 反应③为:2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32- |