题目内容
下列说法中正确的是( )
| A、在船体上镶嵌锌块,可以减缓船体被海水腐蚀的速率 |
| B、粗铜精炼时,电镀液中的c(Cu2+)保持不变 |
| C、纯银在空气中久置变黑发生的是电化学腐蚀 |
| D、阴极电保护法是将被保护的金属与外加电源的正极相连 |
考点:金属的电化学腐蚀与防护,原电池和电解池的工作原理
专题:电化学专题
分析:A.钢铁腐蚀时,铁作负极,碳作正极,负极上铁失电子发生氧化反应;为防止金属铁被腐蚀,可利用牺牲阳极的阴极保护法保护金属,由于还原性Zn>Fe,故在船体上镶嵌锌块,可以减缓船体被海水腐蚀的速率;
B.粗铜中含有活泼性较强铁、锌等杂质,电解过程中优先放电,所以阴极生成的铜离子数目小于阴极消耗的铜离子,从而导致电镀液中铜离子浓度减小;
C.纯银之所以变黑,是银在空气中反应生成硫化银所致,与电化学腐蚀无关;
D.阴极电保护法是将金属与外加电源的负极相连,不是与正极相连.
B.粗铜中含有活泼性较强铁、锌等杂质,电解过程中优先放电,所以阴极生成的铜离子数目小于阴极消耗的铜离子,从而导致电镀液中铜离子浓度减小;
C.纯银之所以变黑,是银在空气中反应生成硫化银所致,与电化学腐蚀无关;
D.阴极电保护法是将金属与外加电源的负极相连,不是与正极相连.
解答:
解:A.碳、铁和海水构成的原电池中,铁失电子作负极,所以负极上电极反应式为:Fe-2e-=Fe2+,为防止金属被腐蚀,可利用牺牲阳极的阴极保护法保护金属,让船体的钢板作原电池正极,选取比铁活泼的金属,如锌作原电池负极,从而能够保护船体,减缓船体被海水腐蚀的速率,故A正确;
B.粗铜精炼时,粗铜作阳极,发生氧化还原反应的金属除了铜,还含有活泼性比铜强的杂质铁、锌等,电解时杂质优先放电,而阴极铜离子得到电子生成铜,导致电镀液中铜离子浓度减小,故B错误;
C.纯银变黑是银在空气中发生反应生成了硫化银,与电化学腐蚀无关,属于化学腐蚀,故C错误;
D.阴极电保护法是将被保护的金属与外加电源的负极相连,若金属与电源正极相连,则金属将失去电子被氧化,无法起到保护作用,故D错误;
故选A.
B.粗铜精炼时,粗铜作阳极,发生氧化还原反应的金属除了铜,还含有活泼性比铜强的杂质铁、锌等,电解时杂质优先放电,而阴极铜离子得到电子生成铜,导致电镀液中铜离子浓度减小,故B错误;
C.纯银变黑是银在空气中发生反应生成了硫化银,与电化学腐蚀无关,属于化学腐蚀,故C错误;
D.阴极电保护法是将被保护的金属与外加电源的负极相连,若金属与电源正极相连,则金属将失去电子被氧化,无法起到保护作用,故D错误;
故选A.
点评:本题考查了金属的腐蚀与防护,题目难度中等,注意掌握金属的电化学腐蚀原理,明确金属防护常用的措施及原理,能够正确辩别电化学腐蚀与化学腐蚀的、析氢腐蚀与吸氧腐蚀,试题有利于培养学生灵活应用所学知识的能力.

练习册系列答案
 53随堂测系列答案
53随堂测系列答案
相关题目
下列表达方式错误的是( )
| A、HCl的电子式 H:Cl |
B、S2-的结构示意图是: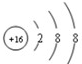 |
| C、O-18原子的符号:818O |
| D、CO2分子的结构式 O=C=O |
在NH4HSO3溶液中逐滴加入Ba(OH)2溶液,下列离子方程式一定错误的是( )
| A、2HSO3-+Ba2++2OH-→BaSO3↓+SO32-+2H2O |
| B、NH4++HSO3-+Ba2++2OH-→BaSO3↓+NH3?H2O+H2O |
| C、NH4++3HSO3-+2Ba2++4OH-→2BaSO3↓+SO32-+NH3?H2O+3H2O |
| D、HSO3-+Ba2++OH-→BaSO3↓+H2O |
下列反应的离子方程式正确的是( )
| A、FeCl3溶液腐蚀铜板电路:Fe3++Cu=Fe2++Cu2+ |
| B、碳酸钙溶于醋酸溶液:CaCO3+2H+=Ca2++CO2↑+H2O |
| C、Ba(OH)2溶液与稀硫酸反应:Ba2++SO42-=BaSO4↓ |
| D、铜与稀硝酸反应:3Cu+2NO3-+8H+=3Cu2++2NO↑+4H2O |
有X,Y两种原子,对它们结构的下列描述中,能说明彼此化学性质一定相似的是( )
| A、电子排布式分别为:1s2和1s22s2 |
| B、X原子M层上只有两个电子,Y原子N层上也只有两个电子 |
| C、X原子的2p亚层上有二对成对电子,Y原子的3p亚层上也有二对成对电子 |
| D、X原子的2p亚层上只有一个未成对电子,Y原子的3p亚层上只有一个未成对电子 |
常温下,Na2CO3溶液中有平衡CO32-+H2O?HCO3-+OH-( )
| A、Na2CO3溶液中:c(Na+)>c(CO32-)>c(OH-)>c(H+) |
| B、加入NaOH固体,溶液pH减小 |
| C、Na2CO3溶液中:c(Na+)+c(H+)═2c(CO32-)+c(OH-) |
| D、升高温度平衡向正反应方向移动 |
下列离子方程式中书写正确的是( )
| A、FeS固体与稀硝酸混合:FeS+2H+=2Fe2++H2S |
| B、NH4HSO4溶液中加入足量Ba(OH)2溶液:H++SO42-+Ba2++OH-═BaSO4+H2O |
| C、将少量SO2气体通入NaClO溶液中:SO2+2ClO-+H2O═SO32-+2HClO |
| D、1.12L(标况)Cl2通入1L 1mol/L的FeI2溶液中:2I-+Cl2=I2+2Cl- |
下列离子方程式中正确的是( )
| A、向溶液Na2FeO4中加入稀H2SO4产生氧气:4FeO42-+2OH-=4Fe2++3O2↑+10H2O |
| B、向溶液NH4Al(SO4)2中滴入溶液Ba(OH)2恰好使(SO4)2-沉淀完全2Ba2++4OH-+Al3++2SO42-═2BaSO4↓+AlO2-+2H2O |
| C、向溶液Mg(HCO3)2中加入过量的NaOH溶液:Mg2++2HCO3-+4OH-=Mg(OH)2↓+2CO32-+2H2O |
| D、向溶液Fe(NO3)2中加入稀氢碘酸:3Fe2++4H++NO3-=3Fe3++NO↑+2H2O |
甲、乙、丙三个烧杯内分别盛放0.1mol的钠、氧化钠和氢氧化钠,然后加入100mL水,搅拌,使固体完全溶解,则三份溶液的质量分数大小的顺序是( )
| A、甲<乙<丙 |
| B、丙<甲<乙 |
| C、甲=丙<乙 |
| D、丙<甲=乙 |