题目内容
2.aX和bY分别是元素X和元素Y的一种同位素,已知a>b,则元素X和Y相对原子质量之间的关系是( )| A. | 大于 | B. | 小于 | C. | 等于 | D. | 无法确定 |
分析 元素的相对原子质量是其各种同位素相对原子质量的加权平均值,故某一种同位素原子的相对原子质量不能作为判断该元素的相对原子质量的依据.
解答 解:元素的相对原子质量是其各种同位素相对原子质量的加权平均值,故无法判断元素X和Y的相对原子质量的大小关系,
故选D.
点评 本题考查元素相对原子质量与同位素的关系,难度不大.要注意基础概念的掌握.

练习册系列答案
 小学课时特训系列答案
小学课时特训系列答案
相关题目
12.a、b、c、d、e、f、g为七种由短周期元素构成的微粒,它们都有10个电子,其结构特点如下:
其中b的离子半径大于e的离子半径;d是溶于水显碱性的四原子分子;c与f作用可生成2个中性分子g.
试写出:
(1)a微粒的原子结构示意图为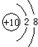
(2)b和e相应元素的最高价氧化物的水化物的碱性强弱比较为:NaOH>Mg(OH)2(用化学式表示).
(3)d的水溶液显碱性的原因(用电离方程式表示)NH3•H2O?NH4++OH-
(4)c微粒是OH-,f微粒是H3O+(用化学式表示).
(5)b相应的元素的单质与g微粒反应的化学方程式为2Na+2H2O=2NaOH+H2↑.
| 微粒代码 | a | b | c | d | e | f | g |
| 原子核数目 | 单核 | 单核 | 双核 | 多核 | 单核 | 多核 | 多核 |
| 带电荷数(单位电荷) | 0 | 1+ | 1- | 0 | 2+ | 1+ | 0 |
试写出:
(1)a微粒的原子结构示意图为
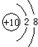
(2)b和e相应元素的最高价氧化物的水化物的碱性强弱比较为:NaOH>Mg(OH)2(用化学式表示).
(3)d的水溶液显碱性的原因(用电离方程式表示)NH3•H2O?NH4++OH-
(4)c微粒是OH-,f微粒是H3O+(用化学式表示).
(5)b相应的元素的单质与g微粒反应的化学方程式为2Na+2H2O=2NaOH+H2↑.
13.下列叙述正确的是( )
| A. | 甲苯既可使溴的四氯化碳溶液褪色,也可使酸性高锰酸钾溶液褪色 | |
| B. | 有机物 的消去产物有两种 的消去产物有两种 | |
| C. | 有机物C4H6O2能发生加聚反应,可推知其结构一定是CH2=CH-COOCH3 | |
| D. | 可用溴水鉴别苯酚、四氯化碳和乙酸 |
10.设NA为阿伏加德罗常数的值,下列叙述中正确的是( )
| A. | 常温下,含1 mol Fe的铁片与过量浓HNO3反应,转移电子的数目为3 NA个 | |
| B. | 19.2 g铜与足量的稀硝酸反应产生NO的体积为4.48 L | |
| C. | 标准状况下,33.6 L SO3含有9.03×1023个SO3分子 | |
| D. | 在46 gNO2和N2O4的混合物气体中所含原子总数为3NA个 |
17.短周期金属元素甲~戊在元素周期表的相对位置如表所示.下列判断正确的是( )
| 甲 | 乙 | |
| 丙 | 丁 | 戊 |
| A. | 最高价氧化物对应的水化物的碱性:丙>丁>戊 | |
| B. | 金属性:甲>丙 | |
| C. | 原子半径:丙<丁<戊 | |
| D. | 最外层电子数:甲>乙 |
9.工业上以锂辉石(Li2O•A12O3•4SiO2,含少量Ca、Mg元素)为原料生产碳酸锂.其部分工艺流程如图1:

已知:①Li2O•Al2O3•4SiO2+H2SO4(浓)$\frac{\underline{\;250-300℃\;}}{\;}$Li2SO4+Al2O3•4SiO2•H2O↓
②不同温度下Li2CO3和Li2SO4的溶解度如下表:
(1)从滤渣1中分离出Al2O3的部分流程如下所示,括号中表示加入过量的试剂,方框表示所得到的物质.则步骤Ⅱ中反应的离子方程式是Al3++3NH3•H2O=Al(OH)3↓+3NH4+.
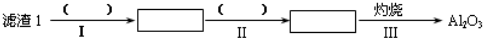
(2)向滤液2中加入饱和Na2CO3溶液,过滤后,用“热水洗涤”的原因是Li2CO3的溶解度随温度升高而减小,热水洗涤可减少Li2CO3的损失.
(3)工业上用电解法将Li2CO3粗品制成高纯Li2CO3,其中向电解后所得的纯LiOH溶液中加入过量NH4HCO3溶液可生成Li2CO3,反应的化学方程式是2LiOH+NH4HCO3=Li2CO3↓+NH3+2H2O.

已知:①Li2O•Al2O3•4SiO2+H2SO4(浓)$\frac{\underline{\;250-300℃\;}}{\;}$Li2SO4+Al2O3•4SiO2•H2O↓
②不同温度下Li2CO3和Li2SO4的溶解度如下表:
| T/℃ | 20 | 40 | 60 | 80 |
| S(Li2CO3)/g | 1.33 | 1.17 | 1.01 | 0.85 |
| S(Li2SO4)/g | 34.2 | 32.8 | 31.9 | 30.7 |
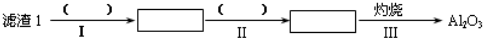
(2)向滤液2中加入饱和Na2CO3溶液,过滤后,用“热水洗涤”的原因是Li2CO3的溶解度随温度升高而减小,热水洗涤可减少Li2CO3的损失.
(3)工业上用电解法将Li2CO3粗品制成高纯Li2CO3,其中向电解后所得的纯LiOH溶液中加入过量NH4HCO3溶液可生成Li2CO3,反应的化学方程式是2LiOH+NH4HCO3=Li2CO3↓+NH3+2H2O.
10.下列关于元素的说法正确的是( )
| A. | 元素周期表中元素种类最多的周期是第6周期 | |
| B. | 第IA族元素均为碱金属元素 | |
| C. | 原子最外层电子数为2的元素一定位于第ⅡA族 | |
| D. | 元素周期表中元素种类最多的族是第Ⅷ族 |