题目内容
17.短周期金属元素甲~戊在元素周期表的相对位置如表所示.下列判断正确的是( )| 甲 | 乙 | |
| 丙 | 丁 | 戊 |
| A. | 最高价氧化物对应的水化物的碱性:丙>丁>戊 | |
| B. | 金属性:甲>丙 | |
| C. | 原子半径:丙<丁<戊 | |
| D. | 最外层电子数:甲>乙 |
分析 由短周期金属元素甲~戊在元素周期表的相对位置,可知甲为Li、乙为Be、丙为Na、丁为Al、戊为Al.
A.金属性越强,最高价氧化物对应水化物的碱性越强;
B.同主族自上而下金属性增强;
C.同周期随原子序数增大,原子半径减小;
D.同周期自左而右最外层电子数增大.
解答 解:由短周期金属元素甲~戊在元素周期表的相对位置,可知甲为Li、乙为Be、丙为Na、丁为Al、戊为Al.
A.同周期自左而右金属性增强,金属性越强,最高价氧化物对应水化物的碱性越强,故最高价氧化物对应水化物的碱性:丙>丁>戊,故A正确;
B.甲、丙同主族,自上而下金属性增强,故金属性:甲<丙,故B错误;
C.同周期随原子序数增大,原子半径减小,故原子半径:丙>丁>戊,故C错误;
D.同周期自左而右最外层电子数增大,甲、乙同周期,乙的原子序数较大,故乙的最外层电子数较多,故D错误;
故选A.
点评 本题考查元素周期表与元素周期律,比较基础,注意对元素周期表的整体把握,掌握同周期、同主族元素化合物性质相似性与递变性.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
7.下列分子中所有原子都满足最外层8电子结构的是( )
| A. | BeCl2 | B. | PCl3 | C. | PCl5 | D. | H2O |
8.元素X原子的最外层有6个电子,元素Y原子的最外层有3个电子,这两种元素形成的化合物的化学式可能是( )
| A. | X3Y2 | B. | X2Y | C. | Y3X2 | D. | Y2X3 |
5.下列叙述中不正确的是( )
| A. | 常温时,某溶液中由水电离出来的c(H+)和c(OH-)的乘积为l×10-24,该溶液中一定可以大量存在K+、Na+、AlO2-、SO42- | |
| B. | 1 mol Na2O和Na2O2混合物中含有的阴、阳离子总数是3NA | |
| C. | 在中和滴定实验中,既可用标准溶液滴定待测液,也可用待测液滴定标准溶液 | |
| D. | 某一反应体系中的物质有:HC1、SnCl2、H2SnCl6、As、H3AsO3、H2O,已知As是产物之一,则该反应配平后H2O的化学计量数为6 |
2.aX和bY分别是元素X和元素Y的一种同位素,已知a>b,则元素X和Y相对原子质量之间的关系是( )
| A. | 大于 | B. | 小于 | C. | 等于 | D. | 无法确定 |
9.用NA表示阿伏伽德罗常数,下列叙述中正确的是( )
| A. | 在标准状态下,1L庚烷完全燃烧后,所生成的气态产物的分子数为$\frac{7}{22.4}$NA | |
| B. | 1mol碳正离子CH5+所含的电子数为10NA | |
| C. | 标准状态下,16g甲烷完全燃烧所消耗的氧气的分子数为2NA | |
| D. | 0.5mol C3H8分子中含C-H共价键2NA |
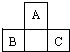 A、B、C为短周期元素,它们的位置关系如图所示,已知B、C两元素原子序数之和是A元素的原子序数的4倍,则
A、B、C为短周期元素,它们的位置关系如图所示,已知B、C两元素原子序数之和是A元素的原子序数的4倍,则 ,A的氢化物分子式为H2O;
,A的氢化物分子式为H2O;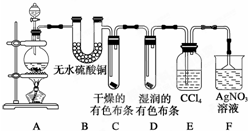 某校化学实验兴趣小组为了探究在实验室制备Cl2的过程中有水蒸气和HCl挥发出来,同时探究氯气的漂白原理,甲同学设计了如图所示的实验装置(支撑用的铁架台省略),按要求回答问题.
某校化学实验兴趣小组为了探究在实验室制备Cl2的过程中有水蒸气和HCl挥发出来,同时探究氯气的漂白原理,甲同学设计了如图所示的实验装置(支撑用的铁架台省略),按要求回答问题.