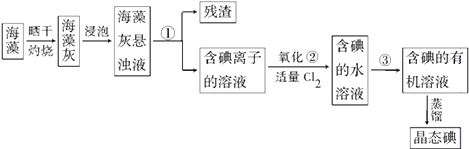
题目内容
【题目】A、B、C、D均为中学所学的常见物质且均含有同一中元素,它们之间的转化关系如图所示(反应条件及其它物质已经略去): ![]()
(1)若A是黄色晶体;B为酸雨的成因之一,且可使品红溶液褪色,则将B通入KMnO4溶液的现象为;体现B的(填“氧化性”“还原性”“漂白性”);请写出D的浓溶液与单质铜反应的化学方程式:;此反应中作氧化剂的D与参加反应的D的物质的量之比为;
(2)若A气体可使湿润的红色石蕊试纸变蓝,常温下D的浓溶液能使金属Fe、Al钝化,请写出实验室制备A的化学方程式:;请写出C→D的离子方程式 .
(3)若A是一种活泼金属,C是淡黄色固体,则C的名称为 , 试用化学方程式表示该物质与二氧化碳气体的反应;将C长期露置于空气中,最后将变成物质E,E的化学式为 .
【答案】
(1)紫红色变为无色;还原性;Cu+2H2SO4(浓) ![]() SO2↑+CuSO4+2H2O;1:2
SO2↑+CuSO4+2H2O;1:2
(2)2NH4Cl+Ca(OH)2 ![]() CaCl2+2NH3+2H2O;3NO2+H2O=2H++2NO3﹣+NO
CaCl2+2NH3+2H2O;3NO2+H2O=2H++2NO3﹣+NO
(3)过氧化钠;2Na2O2+2CO2=2Na2CO3+O2;Na2CO3
【解析】解:(1)若A是黄色晶体;B为酸雨的成因之一,且可使品红溶液褪色,则A为S,B为SO2 , C为SO3 , D为H2SO4 , B为二氧化硫,具有还原性,可与高锰酸钾发生氧化还原反应,使高锰酸钾溶液褪色,浓硫酸具有强氧化性,在加热条件下与铜发生氧化还原反应,反应的方程式为:Cu+2H2SO4(浓) ![]() SO2↑+CuSO4+2H2O,由方程式可知此反应中作氧化剂的D(H2SO4)与参加反应的D(H2SO4)的物质的量之比为1:2,所以答案是:紫红色变为无色;还原性;Cu+2H2SO4(浓)
SO2↑+CuSO4+2H2O,由方程式可知此反应中作氧化剂的D(H2SO4)与参加反应的D(H2SO4)的物质的量之比为1:2,所以答案是:紫红色变为无色;还原性;Cu+2H2SO4(浓) ![]() SO2↑+CuSO4+2H2O;1:2;(2)若A气体可使湿润的红色石蕊试纸变蓝,A为NH3 , 常温下D的浓溶液能使金属Fe、Al钝化,D为HNO3 , 则B为NO,C为NO2 , 实验室制备氨气的化学方程式:2NH4Cl+Ca(OH)2
SO2↑+CuSO4+2H2O;1:2;(2)若A气体可使湿润的红色石蕊试纸变蓝,A为NH3 , 常温下D的浓溶液能使金属Fe、Al钝化,D为HNO3 , 则B为NO,C为NO2 , 实验室制备氨气的化学方程式:2NH4Cl+Ca(OH)2 ![]() CaCl2+2NH3+2H2O,C→D的离子方程式:3NO2+H2O=2H++2NO3﹣+NO,所以答案是:2NH4Cl+Ca(OH)2
CaCl2+2NH3+2H2O,C→D的离子方程式:3NO2+H2O=2H++2NO3﹣+NO,所以答案是:2NH4Cl+Ca(OH)2 ![]() CaCl2+2NH3+2H2O;3NO2+H2O=2H++2NO3﹣+NO;(3)若A是一种活泼金属,C是淡黄色固体,则A为Na,B为Na2O,C为Na2O2 , D为NaOH,C的名称为过氧化钠,与二氧化碳反应方程式为:2Na2O2+2CO2=2Na2CO3+O2 , 将C长期露置于空气中,与空气中二氧化碳、水蒸气反应,氢氧化钠会稀释二氧化碳,最终生成碳酸钠,
CaCl2+2NH3+2H2O;3NO2+H2O=2H++2NO3﹣+NO;(3)若A是一种活泼金属,C是淡黄色固体,则A为Na,B为Na2O,C为Na2O2 , D为NaOH,C的名称为过氧化钠,与二氧化碳反应方程式为:2Na2O2+2CO2=2Na2CO3+O2 , 将C长期露置于空气中,与空气中二氧化碳、水蒸气反应,氢氧化钠会稀释二氧化碳,最终生成碳酸钠,
所以答案是:过氧化钠;2Na2O2+2CO2=2Na2CO3+O2;Na2CO3 .

 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案【题目】下表是元素周期表的一部分, 针对表中的①~⑧种元素,填写下列空白:
主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
2 | ① | ② | ③ | |||||
3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
(1)在这些元素中,化学性质最不活泼的是:______(填具体元素符号,下同)。原子结构示意图为________________ 。元素⑦名称为_______在周期表中的位置________________。
(2)在最高价氧化物的水化物中,酸性最强的化合物的分子式是_______,碱性最强的化合物的化学式是:_____________。
(3)最高价氧化物是两性氧化物的元素是__________;写出它的氧化物与氢氧化钠反应的离子方程式__________________________________________________。
(4)③、⑥、⑦三种元素形成的离子,离子半径由大到小的顺序是(写元素符号)______________。
(5)元素③的氢化物的化学式为________;该氢化物常温下和元素⑦的单质反应的化学方程式为______________________。
(6)写出⑥的最高价氧化物的水化物和①反应的化学方程式:_______________。