��Ŀ����
����Ŀ���±���Ԫ�����ڱ���һ����, ��Ա��еĢ١�����Ԫ��,��д���пհ�:
���� ���� | ��A | ��A | ��A | ��A | ��A | ��A | ��A | 0�� |
2 | �� | �� | �� | |||||
3 | �� | �� | �� | �� | �� |
��1������ЩԪ����,��ѧ�������������:______(�����Ԫ�ط���,��ͬ)��ԭ�ӽṹʾ��ͼΪ________________ ��Ԫ�آ�����Ϊ_______�����ڱ��е�λ��________________��
��2��������������ˮ�����У�������ǿ�Ļ�����ķ���ʽ��_______��������ǿ�Ļ��������ѧʽ��:_____________��
��3������������������������Ԫ����__________��д���������������������Ʒ�Ӧ�����ӷ���ʽ__________________________________________________��
��4���ۡ��ޡ�������Ԫ���γɵ����ӣ����Ӱ뾶�ɴ�С��˳���ǣ�дԪ�ط��ţ�______________��
��5��Ԫ�آ۵��⻯��Ļ�ѧʽΪ________�����⻯�ﳣ���º�Ԫ�آߵĵ��ʷ�Ӧ�Ļ�ѧ����ʽΪ______________________��
��6��д��������������ˮ����͢ٷ�Ӧ�Ļ�ѧ����ʽ��_______________��
���𰸡� Ar 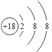 �� �������ڵڢ�A�� HClO4 NaOH Al Al2O3+2OH����2AlO2��+H2O S2����Cl����O2�� H2O Cl2+H2O=HCl+HClO C��2H2SO4(Ũ)
�� �������ڵڢ�A�� HClO4 NaOH Al Al2O3+2OH����2AlO2��+H2O S2����Cl����O2�� H2O Cl2+H2O=HCl+HClO C��2H2SO4(Ũ) ![]() CO2����2SO2����2H2O
CO2����2SO2����2H2O
������������Ԫ�������ڱ��е����λ�ÿ�֪Ԫ�آ١�����C��N��O��Na��Al��S��Cl��Ar����
(1)����ЩԪ���У���ѧ��������õ���ϡ������Ԫ��Ar��ԭ�ӽṹʾ��ͼΪ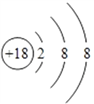 ��Ԫ�آ�����ΪCl�������ڱ��е�λ���ǵ������ڵڢ�A�壻(2)�ǽ�����Խǿ����ۺ����������Խǿ�����������������ˮ�����У�������ǿ�Ļ�����ķ���ʽ��HClO4��������Խǿ������������Ӧˮ����ļ���Խǿ���������ǿ�Ļ�����Ļ�ѧʽ��NaOH��(3)����������������������Ԫ����Al,�������������������Ʒ�Ӧ�����ӷ���ʽΪAl2O3+2OH����2AlO2��+H2O����4�����ӵĺ�����Ӳ���Խ�࣬���Ӱ뾶Խ��������Ų���ͬʱ���Ӱ뾶��ԭ���������������С����ۡ��ޡ�������Ԫ���γɵ����������Ӱ뾶�ɴ�С��˳����S2����Cl����O2������5��Ԫ�آ۵��⻯��Ļ�ѧʽΪH2O�����⻯�ﳣ���º�Ԫ�آߵĵ��ʷ�Ӧ�Ļ�ѧ����ʽΪCl2+H2O=HCl+HClO����6��������������ˮ���������ᣬ�͢ٵĵ���̼��Ӧ�Ļ�ѧ����ʽΪC��2H2SO4(Ũ)
��Ԫ�آ�����ΪCl�������ڱ��е�λ���ǵ������ڵڢ�A�壻(2)�ǽ�����Խǿ����ۺ����������Խǿ�����������������ˮ�����У�������ǿ�Ļ�����ķ���ʽ��HClO4��������Խǿ������������Ӧˮ����ļ���Խǿ���������ǿ�Ļ�����Ļ�ѧʽ��NaOH��(3)����������������������Ԫ����Al,�������������������Ʒ�Ӧ�����ӷ���ʽΪAl2O3+2OH����2AlO2��+H2O����4�����ӵĺ�����Ӳ���Խ�࣬���Ӱ뾶Խ��������Ų���ͬʱ���Ӱ뾶��ԭ���������������С����ۡ��ޡ�������Ԫ���γɵ����������Ӱ뾶�ɴ�С��˳����S2����Cl����O2������5��Ԫ�آ۵��⻯��Ļ�ѧʽΪH2O�����⻯�ﳣ���º�Ԫ�آߵĵ��ʷ�Ӧ�Ļ�ѧ����ʽΪCl2+H2O=HCl+HClO����6��������������ˮ���������ᣬ�͢ٵĵ���̼��Ӧ�Ļ�ѧ����ʽΪC��2H2SO4(Ũ)![]() CO2����2SO2����2H2O��
CO2����2SO2����2H2O��

����Ŀ�����з�����ᴿ��ʵ���У���ѡ�õķ�������������ȷ���ǣ� ��
��� | A | B | C | D |
ʵ��Ŀ�� | ��ȡ����ˮ | ����ˮ��ֲ���� | ����ʳ��ˮ����ɳ | ��Ũʳ��ˮ�еõ��Ȼ��ƾ��� |
���뷽�� | ���� | ��Һ | ��ȡ | ���� |
ѡ������ |
|
|
|
|
A.ѡ��A
B.ѡ��B
C.ѡ��C
D.ѡ��D
����Ŀ����ͼ��Ԫ�����ڱ���һ���֣����еĢ�~����Ԫ�أ���Ԫ�ط��Ż�ѧʽ��ջش�
���� | ��A | ��A | ��A | ��A | ��A | ��A | ��A | 0 |
�� | �� | �� | ||||||
�� | �� | �� | �� | �� | �� | �� | ||
�� | �� |
��1������ЩԪ���У���ѧ��������õ�ԭ�ӵ�ԭ�ӽṹʾ��ͼΪ___________��
��2���ؿ��к������Ľ���Ԫ����____________________________��
��3��������γɵĻ�����ĵ���ʽ______________________________��
��4����ЩԪ���е�����������Ӧ��ˮ�����У�������ǿ����___________��������ǿ����____________�������Ե�����������__________________��
